Cátodo
📧
- Faculdade de Ciências da Universidade do Porto
Referência Lima, L.S., (2015) Cátodo, Rev. Ciência Elem., V3(1):018
DOI http://doi.org/10.24927/rce2015.018
Palavras-chave cátodo; eléctrodo; célula; electroquímica;
Resumo
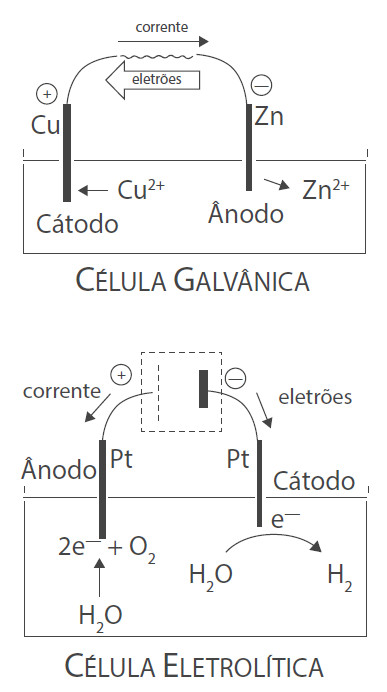
O cátodo é o elétrodo de uma célula eletroquímica onde se dá a redução de uma espécie química. Como a espécie que sofre redução necessita de eletrões e é o ânodo que os fornece, o fluxo de eletrões tem origem no ânodo e dirigese para o cátodo, pelo que a corrente elétrica tem o sentido oposto (do cátodo para o ânodo).
O cátodo, tal como o ânodo, pode ter sinal positivo ou negativo, conforme a célula eletroquímica seja galvânica ou eletrolítica, respetivamente. No caso de uma célula galvânica, a reação de oxidação-redução dá-se de forma espontânea. Assim, os iões presentes na solução de eletrólito onde está mergulhado o cátodo migram para a sua superfície onde sofrem redução, depositando-se sobre este. Como o cátodo tem deficiência de eletrões, adquire uma polaridade positiva. Já numa célula eletrolítica, ocorre a reação de oxidação-redução inversa, devido a uma fonte de tensão que é introduzida no circuito, cuja diferença de potencial origina uma intensidade de corrente no sentido oposto de uma célula galvânica. Por isso, a oxidação passa a ocorrer no elétrodo onde antes ocorria a redução e viceversa. Assim, o cátodo passa a ter sinal negativo.
A palavra cátodo deriva do grego káthodos (katá, “para baixo” + odós, “caminho”), que significa descida (sentido descendente dos eletrões). Tal como no caso do ânodo, a palavra cátodo foi criada em 1834 por William Whewell, um polímato, cientista, padre anglicano, filósofo, teólogo e historiador de ciência inglês do final do século XVIII e século XIX. Contudo, foi Michael Faraday, físico e químico inglês seu contemporâneo, quem utilizou e popularizou o termo após ter solicitado a Whewell novas terminologias para a descrição do processo de eletrólise por ele descoberto.
O fenómeno da deposição de material (um metal, por exemplo) na superfície do cátodo como consequência da reação de redução conduziu ao desenvolvimento da técnica denominada eletrodeposição. Esta consiste na deposição eletroquímica de uma camada de um metal sobre um material, conferindo-lhe propriedades diferentes do material original. Neste caso, o material que vai sofrer a deposição constitui o próprio cátodo. Um exemplo desta técnica é a vulgarmente designada “cromagem”, onde é depositada uma fina camada de crómio metálico no material para prevenir a corrosão, aumentar a dureza da superfície, facilitar a limpeza ou, simplesmente, funcionar como peça decorativa.
Este artigo já foi visualizado 9449 vezes.



