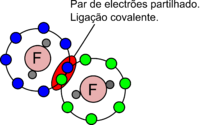
Ligação covalente
📧
- Faculdade de Ciências da Universidade do Porto
Referência Fernandes, R.F., (2015) Ligação covalente, Rev. Ciência Elem., V3(2):137
DOI http://doi.org/10.24927/rce2015.137
Palavras-chave Ligação covalente; química; eletrões;
Resumo
Uma ligação covalente é uma ligação química em que ocorre partilha de eletrões do que resulta uma forte atração entre dois átomos. Neste tipo de ligação os átomos podem partilhar entre si um ou mais pares de eletrões, originando na região internuclear uma maior densidade eletrónica, o que produz uma atração indireta entre os núcleos carregados positivamente, mantendo assim a molécula unida.
O termo covalente deriva do termo covalência, introduzido pelo químico e físico norte-americano Irving Langmuir, baseando-se nos trabalhos do químico norte-americano Gilbert Lewis.1 O termo ligação covalente indica que os átomos ligados partilham eletrões de valência.
As ligações covalentes são classificadas como simples, duplas ou triplas, quando são partilhados um, dois ou três pares de eletrões, respetivamente.
Um dos primeiros cientistas a apresentar uma teoria para explicar a ligação entre os átomos foi Gilbert Lewis, tendo proposto, em 1916, que um par de eletrões partilhados entre dois átomos originava uma atração mútua e consequentemente uma ligação química. De acordo com Lewis, a partilha de eletrões aumenta a estabilidade dos átomos, uma vez que estes passam a ficar rodeados por oito eletrões (regra do octeto) adotando a configuração eletrónica de um gás nobre (figura 1). No entanto, a teoria de Lewis não explica a formação de várias moléculas como, por exemplo, o diborano (B2H6) que apenas apresenta 12 eletrões de valência, ao contrário do previsto pela teoria de Lewis em que seriam necessários 14 eletrões de valência para formar as 7 ligações de modo a manter os oito átomos ligados.
O modelo de Lewis assume que cada par de eletrões para formar uma ligação se encontra entre os dois átomos ligados. No entanto, de acordo com a mecânica quântica, devido ao comportamento ondulatório dos eletrões, estes não se encontram em órbitas bem definidas, mas sim numa determinada região do espaço, designada por orbital, que representa uma determinada probabilidade de encontrar os eletrões. Baseado neste princípio, surgiram outras teorias para explicar a ligação entre os átomos como, por exemplo, a teoria da ligação de valência e a teoria das orbitais moleculares.
A formação de ligações entre átomos é um tema central do estudo da Química. Descrever o mecanismo de ligações entre os átomos conduz a uma compreensão fundamental da estrutura das moléculas. O aparecimento de vários modelos que racionalizam a formação de ligações químicas entre os átomos permite prever se determinadas ligações entre diferentes elementos são possíveis e predizer a reactividade desses mesmos elementos. Por exemplo, é extremamente importante analisar o tipo de ligação que se forma entre a molécula de oxigénio e a hemoglobina durante o processo de transporte do oxigénio ou o tipo de ligações que ocorrem em reacções de polimerização.
Referências
- 1 I. Lamgmuir, J. Am. Chem. Soc., 1919, 41 (6), 868–934, DOI: 10.1021/ja02227a002.
- 2 http://goldbook.iupac.org/C01384.html, consultado em 22/03/2010.
- 3 http://www.meta-synthesis.com/webbook/39_diatomics/diatomics.html, consultado em 22/03/2010.
- 4 http://www.chem1.com/acad/webtext/chembond/cb01.html#SEC1, consultado em 22/03/2010.
- 5 http://www.chem1.com/acad/webtext/chembond/cb03.html, consultado em 22/03/2010.
- 6 http://www.chemguide.co.uk/atoms/bonding/covalent.html#top, consultado em 22/03/2010.
Este artigo já foi visualizado 6682 vezes.