Metal
📧
- Faculdade de Ciências da Universidade do Porto
Referência Fernandes, R.F., (2015) Metal, Rev. Ciência Elem., V3(2):144
DOI http://doi.org/10.24927/rce2015.144
Palavras-chave Metal
Resumo
Um metal é um elemento que tem capacidade de conduzir a eletricidade e o calor, é maleável, dúctil e apresenta, geralmente, um aspeto brilhante (lustroso).
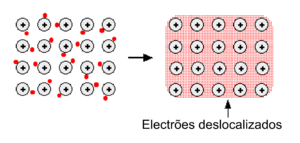
Os metais tendem a ter elevadas temperaturas de fusão e de ebulição, o que indica que os átomos que os compõem estão fortemente ligados entre si. Num metal, os átomos encontram-se ionizados (catiões), ocupando posições bem definidas na estrutura cristalina. Os eletrões de valência deslocam-se facilmente ao longo dessa estrutura, formando uma nuvem de eletrões deslocalizados (figura 1). Deste modo, as ligações entre os átomos de um metal - ligações metálicas - são efetuadas através da atração eletrostática entre os iões positivos do metal e os eletrões que se movem à sua volta. Esta deslocalização dos eletrões permite que os metais tenham uma boa capacidade de conduzir eletricidade e calor.
A história humana é marcada por diferentes eras de diversos metais (e.g. era do cobre, do estanho, do ferro), nas quais as descobertas dos novos elementos modificaram os paradigmas tecnológicos e sociais de cada época. O ouro foi dos primeiros metais a ser descoberto e rapidamente começou a ser usado como moeda de troca. No Médio Oriente, por volta de 6000 A. C., o cobre era extraído por aquecimento de uma mistura de carvão com minérios, tendo sido utilizado para fazer os primeiros instrumentos metálicos (copos, láminas, etc.).
Os metais e a sua reatividade foram intensamente estudados pelos alquimistas que acreditavam na transmutação, ou seja, a conversão de metais, como o estanho ou chumbo em metais nobres, como o ouro. Dalton acabou formalmente com a alquimia uma vez que propôs que as mudanças ocorridas na matéria resultavam do rearranjo de átomos já existentes. Assim sendo, os átomos de um elemento não podiam transformar-se nos átomos de outro elemento.
Os metais, desde a sua descoberta, começaram a ser misturados com outros elementos para conferir aos metais novas características, criando-se as ligas metálicas, como por exemplo, o bronze (mistura de cobre e estanho), ou o latão (mistura de cobre e zinco).
Na tabela periódica os metais encontram-se na parte esquerda e central, correspondendo a cerca de 80 % dos elementos. Encontram-se separados dos não metais, que se encontram na parte superior direita, por um conjunto em diagonal de elementos denominados semi-metais, que vai desde o boro até ao polónio. Dentro da tabela periódica, os metais estão agrupados em alcalinos, alcalinoterrosos, de transição, lantanídeos e actinídeos, etc.
Geralmente, os metais reagem com os não metais, como por exemplo o oxigénio e o enxofre, formando óxidos e sulfuretos. Os metais alcalinos são muito reativos e reagem violentamente com a água. No entanto, os metais nobres, como a prata, o ouro e a platina, são muito pouco reativos e praticamente não são minimamente atacados.
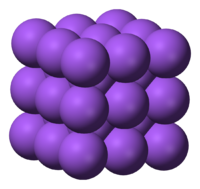
O empacotamento dos átomos metálicos em estruturas compactas (FIGURA 2) leva a que apresentem densidades elevadas e que se encontrem quase todos no estado sólido à temperatura ambiente, à exceção do gálio, mercúrio, césio e frâncio que se encontram no estado líquido.
Os metais apresentam variadas aplicações no quotidiano, de acordo com as particularidades de cada metal: Metais com baixas entalpias de vaporização, como o sódio e o mercúrio, são utilizados em lâmpadas de descarga elétrica, como as lâmpadas fluorescentes e lâmpadas de iluminação pública. O tungsténio, que apresenta temperatura de fusão e entalpia de vaporização elevadas, é utilizado em filamentos de lâmpadas incandescentes.
Dada a baixa reatividade de alguns metais, estes são utilizados em processos de eletrodeposição, de modo a evitar a corrosão do metal revestido.
Alguns metais também são usados para o armazenamento de hidrogénio, atuando como se fossem esponjas formando hidretos pela incorporação de átomos de hidrogénio nas cavidades da estrutura cristalina do metal.
Os metais apresentam variadas aplicações no quotidiano, de acordo com as particularidades de cada metal:
- Metais com baixas entalpias de vaporização, como o sódio e o mercúrio, são utilizados em lâmpadas de descarga elétrica, como as lâmpadas fluorescentes e lâmpadas de iluminação pública.
- O tungsténio, que apresenta temperatura de fusão e entalpia de vaporização elevadas, é utilizado em filamentos de lâmpadas incandescentes.
- Dada a baixa reatividade de alguns metais, estes são utilizados em processos de eletrodeposição, de modo a evitar a corrosão do metal revestido.
- Alguns metais também são usados para o armazenamento de hidrogénio, atuando como se fossem esponjas formando hidretos pela incorporação de átomos de hidrogénio nas cavidades da estrutura cristalina do metal.
Referências
- 1 General Chemistry Glossary, consultado em 15/01/2010.
- 2 Chemguide: Metallic Bonding, consultado em 15/01/2010.
Este artigo já foi visualizado 4188 vezes.