Enzima
📧
- Faculdade de Ciências da Universidade de Lisboa
Referência Moreira, C., (2015) Enzima, Rev. Ciência Elem., V3(3):162
DOI http://doi.org/10.24927/rce2015.162
Palavras-chave centro ativo; substrato; centro alostérico; inibição competitiva; holoenzima; apoenzima; complexo enzima-substrato; temperatura; pH; inativação; desnaturação, inibidor; inibição alostérica; inibição competitiva; cofactor; coenzima; especificidade absoluta
Resumo
As enzimas são um grupo de substâncias orgânicas, quase sempre proteínas, que catalizam as reações, ou seja, facilitam o processo ao baixar a energia de ativação necessária, sem nela participarem – são catalisadores.
São fundamentais na homeostase dos organismos, dado que sem a sua presença muitas reações bioquímicas não ocorreriam. São a base química de toda a vida conhecida.
Nas reações enzimáticas, as moléculas iniciais ou substratos são convertidas pela ação enzimática em moléculas diferentes, os produtos. A atividade enzimática pode ser afetada por outras moléculas inibidoras ou ativadoras da sua atividade. A temperatura também é um fator importante, dado que diferentes enzimas têm intervalos ótimos de temperatura para uma mais eficiente atividade. O pH e a concentração do substrato também afetam a atividade enzimática.
As enzimas têm um intervalo de pH e temperatura ótimos durante o qual a sua atividade é máxima. Abaixo e acima dos valores ótimos de pH a atividade enzimática decresce. O efeito da temperatura na atividade enzimática é diferente. À medida que a temperatura sobe a taxa de atividade da enzima aumenta até atingir o seu máximo, e simultaneamente há uma progressiva inativação por desnaturação da proteína que se acentua quando a temperatura está acima do ótimo.
As enzimas são especificas para determinados substratos, ou seja, existe uma relação de complementaridade entre a enzima e o respetivo substrato. Algumas enzimas ligam-se apenas a um tipo de substrato catalisando uma única reação – especificidade absoluta. Outras enzimas ligam-se a diferentes substratos quimicamente semelhantes, catalisando consequentemente várias reações – especificidade relativa.
As enzimas possuem um local – centro ativo – onde se liga o substrato da reação. As ligações químicas entre enzima e substrato são, geralmente, muito fracas e não covalentes, para serem reversíveis. Quando enzima e substrato se ligam formam o complexo enzima-substrato. A ligação enzima-substrato é do tipo chave-fechadura (proposto por Emil Fischer em 1894), isto é, quer a enzima quer o substrato têm formas estruturais complementares, fazendo com que se encaixem os pares específicos. Mais tarde em 1958, Daniel Koshland propôs o que ficou conhecido por modelo chave-fechadura induzido, defendendo que os centros ativos das enzimas são estruturas flexíveis que alteram a sua forma através da interação com o substrato (FIGURA. 1).
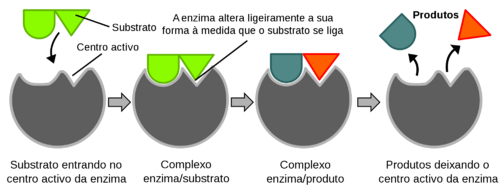
Algumas enzimas requerem uma associação a moléculas não proteicas para a sua atividade – os cofatores. O complexo enzima-cofactor ativo cataliticamente denomina-se holoenzima. Se o cofator for removido, a proteína inativa denomina-se por apoenzima. A maioria dos cofatores são iões inorgânicos, co-enzimas ou grupos prostéticos.
Iões metálicos inorgânicos – podem ser parte integrante da estrutura da proteína ou podem estar associados com o substrato, facilitando a ligação e a atividade catalítica. Por exemplo, ião Fe2+ associado ao grupo heme da peroxidase e da catalase encontra-se ligado à própria proteína (enzima).
Coenzimas – são substâncias orgânicas com peso molecular relativamente baixo quando comparado com o das enzimas. Muitas coenzimas possuem um molécula de vitamina na sua estrutura. As coenzimas funcionam como um tipo de substrato para as enzimas ligando-se a elas. Têm funções específicas como a transferência de hidrogénio (o NAD+ em reações de desidrogenase, por exemplo, na respiração e fermentação) ou de grupos acil (a coenzima A no metabolismo dos ácidos gordos).
Grupo prostético - quando a coenzima está fortemente ligada à enzima e não há uma quebra dessa ligação após o ciclo catalítico.
As enzimas podem ser alteradas por outras moléculas – enzimas alostéricas – possuindo para além do centro ativo um outro centro específico para essas substâncias se ligarem – o centro alostérico. Estas moléculas permitem à célula controlar a atividade enzimática, alterando a conformação da enzima sem que a afinidade ao substrato diminua – inibição alostérica. Em vias metabólicas este tipo de regulação é muito comum. O produto final da via metabólica pode ser atuar como inibidor alostérico de uma enzima presente na cadeia de reações, a inativação da enzima inibe a formação de determinado produto por retroalimentação negativa (ou feedback negativo).
Algumas destas substâncias que reduzem a atividade enzimática – os inibidores – atuam direta ou indiretamente influenciando as propriedades catalíticas do centro ativo. Os inibidores podem ser reversíveis, quando reagem com a enzima estabelecendo um equilíbrio entre as formas ligadas e não ligadas – inibição reversível.
Alguns inibidores podem-se ligar ao centro ativo competindo com o substrato – inibição competitiva (FIGURA. 2). Para isso o inibidor tem de possuir uma estrutura química semelhante à do substrato. Por exemplo, a glucose oxidase cujo substrato normal é a D-glucose pode ser inibida pela molécula de D-arabinose, uma pentose tal como a glucose com um estrutura semelhante.
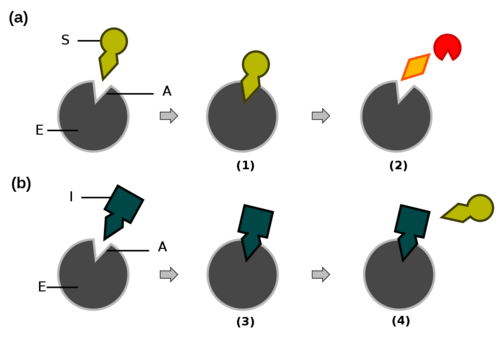
a) reação enzimática normal do complexo enzima-substrato b) inibição enzimática A. Centro ativo S. substrato E. enzima I. Inibidor (1). Substrato liga-se à enzima (2). Enzima liberta produtos da reação (3). Inibidor liga-se à enzima (4). Inibidor compete com o substrato
Este artigo já foi visualizado 9823 vezes.



