Eutéctico
📧
- CICECO/ Universidade de Aveiro
Referência Araújo, C., (2017) Eutéctico, Rev. Ciência Elem., V5(1):003
DOI http://doi.org/10.24927/rce2017.003
Palavras-chave Temperatura; Fusão; Fase; Sólido; Líquido; Gasoso
Resumo
O termo ‘eutéctico’, do grego eutēktos “que funde facilmente”, refere-se a uma mistura sólida homogénea que, numa dada composição, apresenta a temperatura de fusão mais baixa para aquele sistema, que é sempre inferior à temperatura de fusão dos componentes puros e à de qualquer outra mistura destes noutra proporção1.
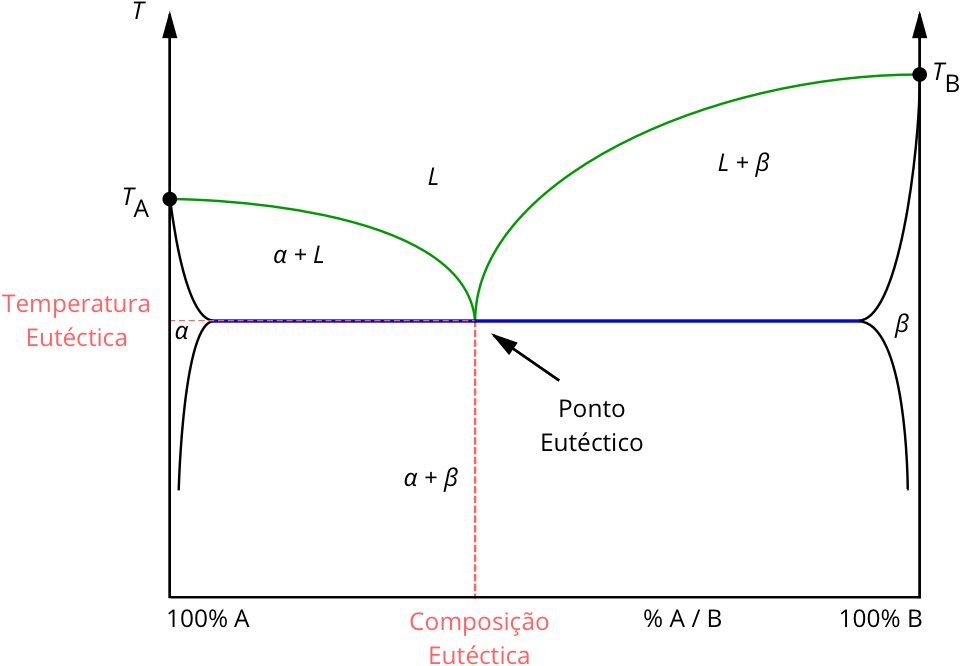
O ponto eutéctico (composição e temperatura eutéctica) pode ser visualizado num diagrama de fases de um dado sistema. Tomemos como exemplo a mistura de “A” com “B”, cujo diagrama de fases é representado esquematicamente na Figura 1. Os eixos verticais marcam a temperatura de fusão, e o eixo horizontal a composição da mistura.
À medida que aumentamos a proporção de “A” relativamente “B” a temperatura de fusão (representada a verde) decresce gradualmente, até atingir um mínimo – temperatura eutéctica – quando se atinge a proporção ou composição, eutéctica. O aumento progressivo do teor em “B” após a composição eutéctica, leva a um aumento da temperatura de fusão da mistura sólida até ao ponto de fusão de “B” puro.
Note-se que a composição do ponto eutéctico é a única composição em que a mistura dos sólidos funde a uma temperatura fixa, passando ao estado líquido na forma de uma solução com a composição existente na proporção da mistura sólida. Em qualquer outra proporção, ao aumentar a temperatura acima da linha (linha azul) que delimita a fase sólida, uma parte da mistura funde (com a composição eutéctica) e parte do componente em excesso (“A” ou “B”) mantém-se na fase sólida. Com o progressivo aumento da temperatura a partir da temperatura eutéctica o sólido em excesso funde e dissolve-se na solução até atingir a temperatura descrita pela linha verde formando uma solução monofásica com a mesma composição da mistura sólida inicial.
Exemplos clássicos de sistemas eutécticos são algumas ligas metálicas chumbo e estanho (usadas, por exemplo, como solda) ou uma mistura de cloreto de sódio com água (usada para fundir a neve). O termo “eutéctico” tem sido recentemente popularizado graças ao desenvolvimento de aplicações que envolvem solventes baseados em misturas de substâncias que conduzem a um abaixamento de temperatura de fusão muito acentuado, chamado eutéctico profundo.
Referências
- 1 Peter Atkins, Julio de Paula, Physical Chemistry. 9th Edition, 2017, Oxford University Press, 9th Edition, 2017, ISBN: 978-1429218122.
Este artigo já foi visualizado 4043 vezes.



