Carbaniões
📧
- Universidade do Porto
Referência Corrêa, C., (2015) Carbaniões, Rev. Ciência Elem., V3(3):270
DOI http://doi.org/10.24927/rce2015.270
Palavras-chave
Resumo
Os carbaniões1, intermediários reativos em muitas reações orgânicas, são aniões em que a carga negativa está associada a um átomo de carbono, embora esteja normalmente deslocalizada sobre outros átomos. São as bases conjugadas de moléculas orgânicas, R-H, por remoção de um protão de uma ligação C-H.
R−H+B:→R⊖+BH⊕
No carbanião metilo, CH−3 -, a carga está concentrada no átomo de carbono, mas nos carbaniões cianometilo, NC−CH−2 -, e nitrometilo, O2N−CH−2 -, a carga encontra-se deslocalizada também sobre os grupos ciano e nitro:
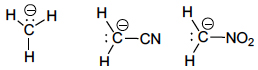
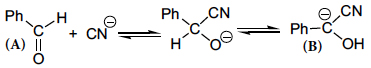
Os carbaniões são normalmente muito reativos, o que lhes confere uma vida bastante curta. A primeira proposta da intervenção de carbaniões como intermediários em Química Orgânica foi apresentada em 1907 por R. W. L. Clarke e A. Lapworth2 no mecanismo da condensação do benzaldeído (A), catalisada pelo ião cianeto, em que intervém um carbanião (B) intermediário na formação da benzoína, Ph−CO−CHOH−Ph.
Estabilização de carbaniões
A estabilidade dos carbaniões pode ser avaliada pela extensão da reação de remoção de um protão por uma base. O deslocamento deste equilíbrio será tanto maior quanto maior for a estabilidade do carbanião. Assim, para carbaniões mais estabilizados, ΔGo é menor, e a reação é mais completa (a constante de acidez, Ka, é maior). O carbanião R´–, a que corresponde um menor valor de \(ΔGo\) para a remoção de um protão, será mais estabilizado que o carbanião R−.
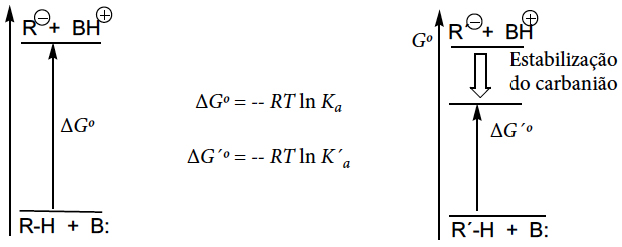
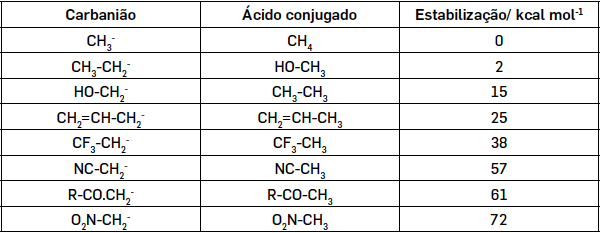
A estabilidade dos carbaniões aumenta se existir um átomo ou grupo de átomos atraidor de electrões ligado ao carbono com carga negativa. Assim, grupos e átomos que exercem efeito indutor –I e mesomérico –M, estabilizam os carbaniões, aumentando a constante de acidez dos ácidos conjugados RH. A TABELA 1 mostra valores da energia de estabilização do carbanião metilo quando se substitui um átomo de hidrogénio.
A estabilização dos carbaniões pode, assim, avaliar-se a partir dos valores das constantes de acidez dos respetivos ácidos conjugados. Na literatura estão disponíveis valores de pKa (−logKa) de muitos ácidos, sendo apresentados alguns na TABELA 2.
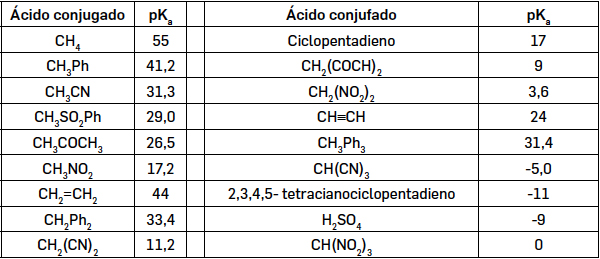
Quanto mais completa for uma reação, menor será o valor de pK. O elevado valor do pKa do metano mostra a dificuldade em se formar o carbanião metilo, em que a carga negativa está praticamente toda localizada no átomo de carbono. À medida que a carga vai sendo deslocalizada (por efeito mesomérico) a estabilidade do carbanião aumente e o valor de pKa diminui. É o que sucede no carbanião benzilo, onde a deslocalização se estende por todo o anel.
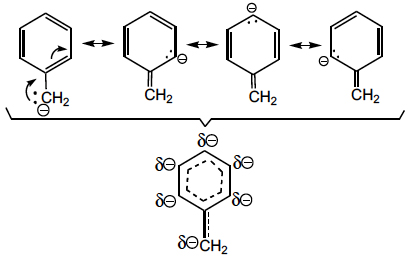
A deslocalização electrónica (mesomerismo, ressonância) e o efeito indutor podem actuar simultaneamente, como sucede com a presença dos grupos ciano, nitro e outros fortemente atraídores de electrões por efeito indutor (– I) e mesomérico (– M) negativos, aumentando a estabilização dos carbaniões, como sucede nos carbaniões cianometilo, fenilsulfonilmetilo, acetilmetilo e nitrometilo. Por esta razão, a sua estabilização é superior à estabilização no carbanião benzilo, em que o efeito indutor é menos significativo. Esta deslocalização electrónica representa-se utilizando as seguintes estruturas contribuintes (ressonância):
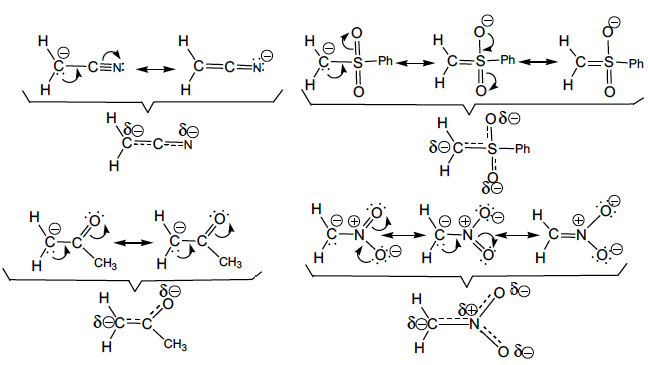
A verdadeira estrutura destes carbaniões é algo parecido com as representações inseridas por baixo das chavetas e significa que na partícula não existem nem ligações duplas, nem ligações simples, nem ligações triplas, mas ligações com carácter intermédio entre duplo e simples e duplo e triplo, que se representaram por traços tracejados sobre traços cheios. Mostra, igualmente, que a carga negativa não está localizada num só átomo mas distribuída pelos átomos de carbono, azoto e oxigénio.
Dos valores das energias de estabilização de carbaniões e dos valores de pKa apresentados pode deduzir-se a seguinte estabilidade relativa:
CH3NO2>CH3COCH3>CH3SO2Ph>CH3CN>CH3Ph≫CH4
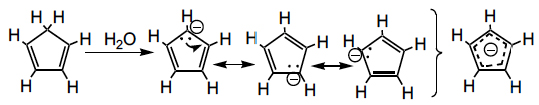
O carbanião derivado do ciclo-hexatrieno é aromático, pois tem 4n+2 electrões π deslocalizados num anel, apresentando elevada estabilidade. Se se introduzirem neste carbanião grupos fortemente atraídores de electrões, como quatro grupos ciano, o carbanião passa a ser tão estável que o seu ácido conjugado (pKa=−11) é mais forte que o ácido sulfúrico (pKa=−9), dissociando-se completamente na presença de uma base tão fraca como a água.
Geometria de carbaniões
A geometria em torno do átomo de carbono do carbanião metilo é piramidal, como sucede na molécula de amoníaco, devido à presença do par electrónico não ligante do carbono (orbital sp3). As ligações C-H são formadas a partir de orbitais atómicas sp3 do carbono e s do hidrogénio.
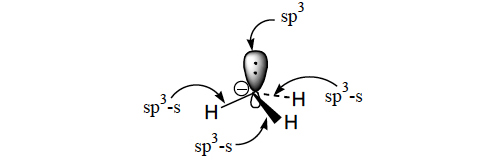
Nos carbaniões benzilo, cianometilo, fenilsulfonilmetilo, acetilmetilo, nitrometilo, alilo e outros a carga negativa está deslocalizada sobre todo o sistema. Para ocorrer esta deslocalização é necessário que o sistema seja plano, como sucede no carbanião alilo, para que os eixos das orbitais atómicas pz sejam paralelos e possibilitem a formação de orbitais moleculares deslocalizadas, de menor energia.
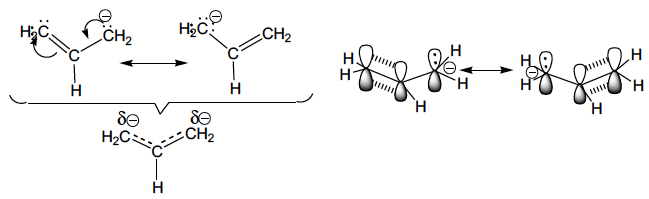
As três orbitais moleculares (OM) π do carbanião resultantes da combinação das três orbitais atómicas p do carbono, são as seguintes:
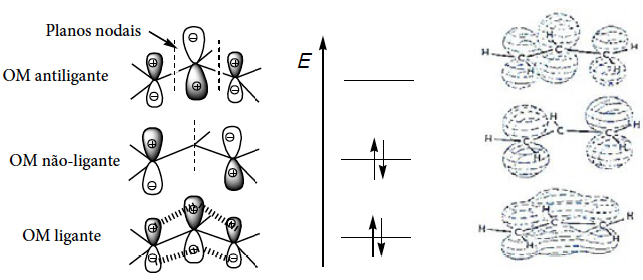
A OM de menor energia está completamente preenchida e estendese sobre todo o sistema, o que confere às ligações C-C um caráter intermédio entre ligação simples e ligação dupla (3 electrões em cada ligação, ou seja, dois electrões σ e um electrão π entre dois carbonos). A OM não-ligante está também completamente preenchida, o que faz com que haja excesso de carga negativa nos átomos de carbono laterais (o que equivale a dizer que é neles onde existe excesso de carga negativa, como as estruturas contribuintes mostram).
Enquanto no carbanião benzilo a carga negativa está deslocalizada sobre o anel, no carbocatião fenilo a carga encontra-se centrada no carbono pois o eixo da orbital sp2 do carbono totalmente preenchida é perpendicular aos eixos das orbitais pz combinadas no anel, não podendo combinar-se com elas.
Formação de carbaniões
O modo mais comum de formação de carbaniões é a remoção de protões de ligações C−H por ação de bases. Podem, também, formar-se pela adição de nucleófilos a ligações duplas C=C desde que existam presentes grupos fortemente atraídores de electrões, como sucede no cianoacrilato de metilo, que polimeriza facilmente na presença de água e vestígios de bases:
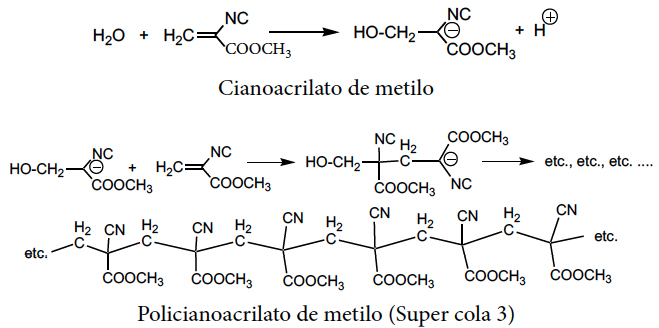
Os compostos organometálicos, como os organomagnesianos, RMgX, e alquillítio, RLi, com ligações metal-C bastante polarizadas, embora não gerem carbaniões livres, reagem do mesmo modo.
Algumas reações em que intervêm carbaniões
- Halogenação de cetonas catalisada por bases.
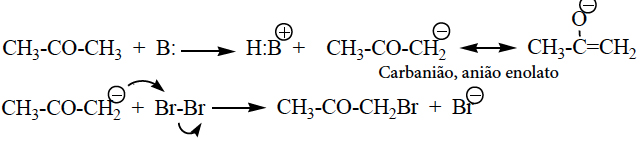
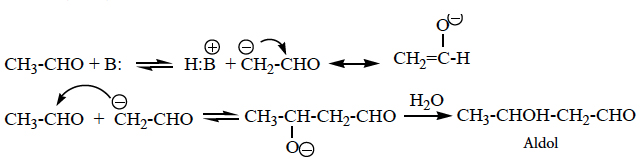
- Condensação alcoólica
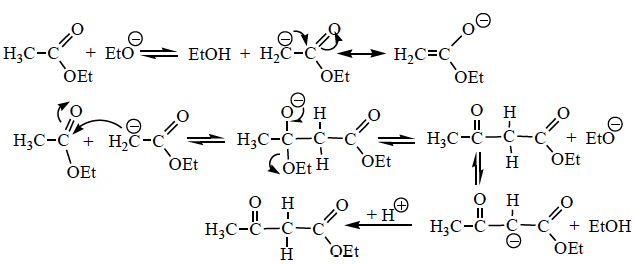
- Condensação de Claisen
Referências
- 1 CAREY, F. A. & SUNDBERG, R. J. Advanced Organic Chemistry, Part A, pp 373-390; parte B, pp1-10, 2ª edição, Plenum Press. 1984.
- 2 CLARKE, W. R. & LAPWORTH A. J.Chem. Soc., Transactions, 91, 694. 1907.
Este artigo já foi visualizado 2827 vezes.



