Embriões de peixe-zebra (Danio rerio)
📧 , 📧 , 📧 , 📧 , 📧 , 📧
- * UTAD
- ɫ UTAD
- ‡ UTAD
- + 1H-TOXRUN/ CESPU
- # Inov4Agro
- § Inov4Agro
Referência Ribeiro, O. M., Félix, L., Monteiro, S. M., Ribeiro, C., Fontainhas-Fernandes, A., Carrola, J. S., (2024) Embriões de peixe-zebra (Danio rerio), Rev. Ciência Elem., V12(1):003
DOI http://doi.org/10.24927/rce2024.003
Palavras-chave
Resumo
A utilização de modelos animais vertebrados na investigação tem sido fundamental para a compreensão dos processos fisiopatológicos humanos. No entanto, nas últimas duas décadas, a utilização de modelos vertebrados alternativos tem vindo a aumentar, tendo em conta o princípio dos 3 Rs proposto por William Russell e Rex Burch em 1959. Neste sentido, o uso do peixe-zebra (Danio rerio) como modelo na investigação de ciências biomédicas e patologias humanas teve um aumento considerável. De facto, esta espécie apresenta um conjunto de características bioquímicas, fisiológicas, genéticas morfológicas e embriológicas que o tornam um modelo de estudo muito utilizado. Possui um ciclo de vida rápido, reprodução durante todo o ano, fecundidade elevada, e, além disso, o córion é transparente e o embrião semitransparente, o que torna a observação do desenvolvimento embrionário muito fácil usando uma lupa ou microscópio. Acrescem a estas vantagens considerações éticas na avaliação do potencial teratogénico de compostos químicos, como sejam o facto das fases iniciais de vida até às 120 horas após fertilização, não serem consideradas como “animais experimentais”, de acordo com a diretiva da União Europeia 2010/63/EU, transposta para o Decreto-lei 113/2013, respeitante à proteção dos animais utilizados para fins experimentais e outros fins científicos.
Este trabalho pretende fazer uma abordagem geral sobre a utilização do embrião de peixe-zebra como modelo animal para: a) avaliar o potencial teratogénico de compostos; b) analisar algumas das metodologias usadas para avaliação das malformações e c) utilização de diferentes parâmetros como indicadores de toxicidade. São também abordadas as diferentes formas de classificação das malformações e a sua severidade de forma a classificar os compostos químicos como teratogénicos ou não.
Modelos animais na investigação biomédica.
O uso de modelos animais vertebrados na investigação biomédica remonta ao século VI a.C, na
Grécia Antiga, para o estudo da anatomia e fisiologia humana. Apesar das grandes descobertas
no período inicial da investigação, ainda havia diversos equívocos e lacunas sobre o funcionamento
do corpo humano. Só no Renascimento (séculos XIV a XVI) é que os organismos modelo
contribuíram para uma verdadeira mudança na compreensão da histologia e fisiologia humana,
o que levou à sua utilização até aos dias de hoje26, 27 Desde o século passado, estes modelos animais têm vindo a ser utilizados para entender as
doenças humanas e os seus mecanismos fisiopatológicos a nível celular e molecular43, bem
como para o desenvolvimento de novos fármacos, vacinas, terapias, entre outros6. A investigação biomédica centrou-se muito na utilização de roedores, devido à sua semelhança
anatómica, fisiológica, bem como à sua elevada homologia com o genoma humano16. Contudo, diversos outros vertebrados podem ser utilizados, tais como anfíbios, peixes, coelhos,
cães, incluindo, em situações excecionais, primatas não-humanos. No entanto, a preocupação crescente com o bem-estar animal veio alterar o panorama da utilização
de animais como modelos para investigação e para fins pedagógicos39. Esta preocupação
remonta já a 1959, quando William Russell e Rex Burch publicaram o livro Os Princípio Humanitário
da Técnica Experimental55, pioneiros na formulação do princípio dos 3 Rs (Replacement,
Reduction and Refinement, em português Substituição, Redução e Refinamento). Este princípio é
cientificamente aceite e tem sido implementado na legislação mundial relativa à experimentação
animal27, 47 e também na legislação portuguesa, em particular o Decreto-lei 113/2013, respeitante
à proteção dos animais utilizados para fins experimentais e outros fins científicos. Com o aumento da investigação a nível global, registou-se também um incremento no número
de animais vertebrados utilizados. No entanto, em consonância com a crescente preocupação
com o bem-estar animal, tornou-se necessário desenvolver ensaios e metodologias
alternativas considerando a necessidade, viabilidade, ética, potencial dano causado e o retorno
da investigação realizada8. Essas alternativas incluem ensaios in silico (simulações computacionais)
57 e in vitro (realizados em ambiente controlado de laboratório)67 contribuindo de forma
relevante na substituição e na redução do número de animais utilizados52. Nos últimos anos, tem havido um interesse científico crescente em estabelecer organismos
modelo alternativos para substituir mamíferos e vertebrados superiores, em conformidade com
o já referido princípio dos 3 Rs. Alguns exemplos de organismos modelo alternativos são a mosca-
da-fruta (Drosophila melanogaster)35, o nemátodo terrestre (Caenorhabditis elegans)11 e o peixe-
zebra (Danio rerio)2, 33, 38, 53. Esses organismos oferecem oportunidades valiosas, permitindo
avanços científicos sem a necessidade de utilizar animais vertebrados de maior complexidade. Substituição de roedores por Peixe-zebra nos estudos de teratogénese. A utilização de testes de toxicidade in vivo com roedores tem permitido a avaliação dos efeitos
induzidos por tóxicos no seu desenvolvimento embrionário, no entanto, a sua utilização
na investigação fundamental e aplicada tem diminuído9, 19. Como alternativa, o peixe-zebra
tem vindo a ganhar destaque devido à semelhança e conservação dos seus mecanismos moleculares
com os mamíferos, durante a organogénese4. Adicionalmente, a organogénese da
maioria dos órgãos do peixe-zebra é concluída até aos 5 dias após-fertilização, muito mais
rápida do que em roedores. Esta rapidez e a comparabilidade dos resultados têm validado o
peixe-zebra como um modelo experimental adequado, resultando num aumento considerável
da sua utilização em detrimento do rato (Rattus norvegicus) e/ou do murganho (Mus musculus).
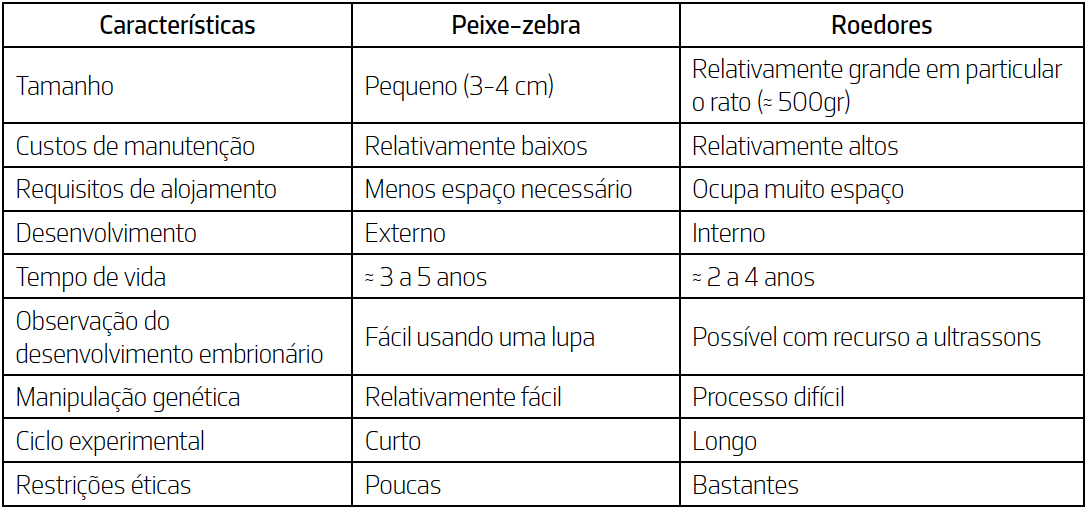
Adicionalmente, o peixe-zebra oferece uma série de vantagens em relação aos modelos
roedores (TABELA 1). Como consequência, este organismo tem vindo a ser crescentemente utilizado
para estimar o potencial teratogénico de compostos tóxicos em outros vertebrados e em
humanos43, 56, 68. Num estudo realizado por Jarque et al.34, foram testados 31 compostos e os
resultados mostraram que o peixe-zebra pode ser utilizado para prever a teratogenicidade em
mamíferos, apresentando elevada sensibilidade (94,44%), especificidade (90,91%) e precisão
(87,10%), de forma similar aos roedores. Apesar do peixe-zebra não substituir completamente os roedores como modelo para prever
a toxicidade durante o desenvolvimento, é útil para fazer uma estimativa preliminar de teratogenicidade
para muitos compostos e é um ótimo modelo em ensaios ecotoxicológicos)12, 13, 51, 62. O Peixe-zebra como organismo modelo. O peixe-zebra emergiu como modelo animal a partir da década de 198061, principalmente
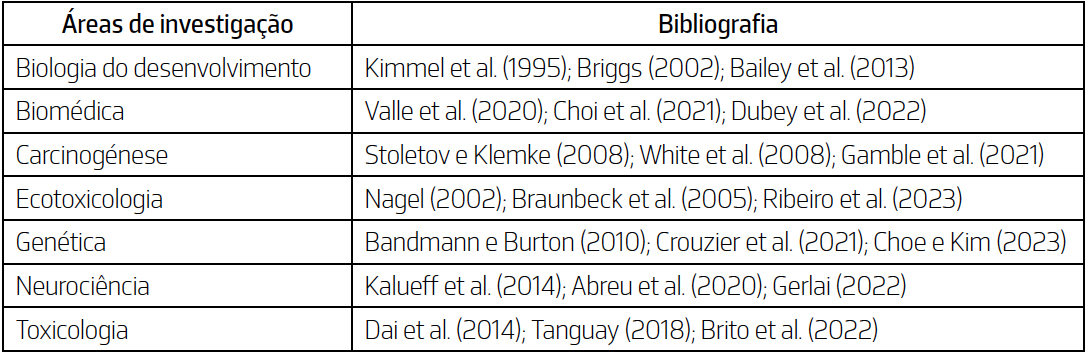
na área da biologia do desenvolvimento. No entanto, ao longo dos anos, o peixe-zebra
tem-se estabelecido como organismo modelo em diversas áreas de investigação, como
evidenciado na TABELA 2. A sua versatilidade e características favoráveis têm impulsionado
o seu uso em estudos sobre diversos aspetos biológicos e fisiológicos, tornando-o
numa ferramenta valiosa para a compreensão dos mecanismos biológicos e a investigação
de doenças. D. rerio compartilha muitas características com outras espécies de vertebrados, apresentando
um plano corporal básico de cordados, incluindo notocorda, neurocrânio, células da
crista neural, estruturas epidérmicas definidas, placódios sensoriais e estruturas neurológicas
distintas8, 41, 44. Estas semelhanças tornam o peixe-zebra um modelo ideal para estudar
uma ampla gama de processos biológicos, desde o desenvolvimento embrionário até à
resposta imunológica. Permite ainda fazer a microinjeção celular, uma técnica útil para introduzir
tóxicos ou toxinas diretamente no ovo22, e mimetizando a transferência parental58
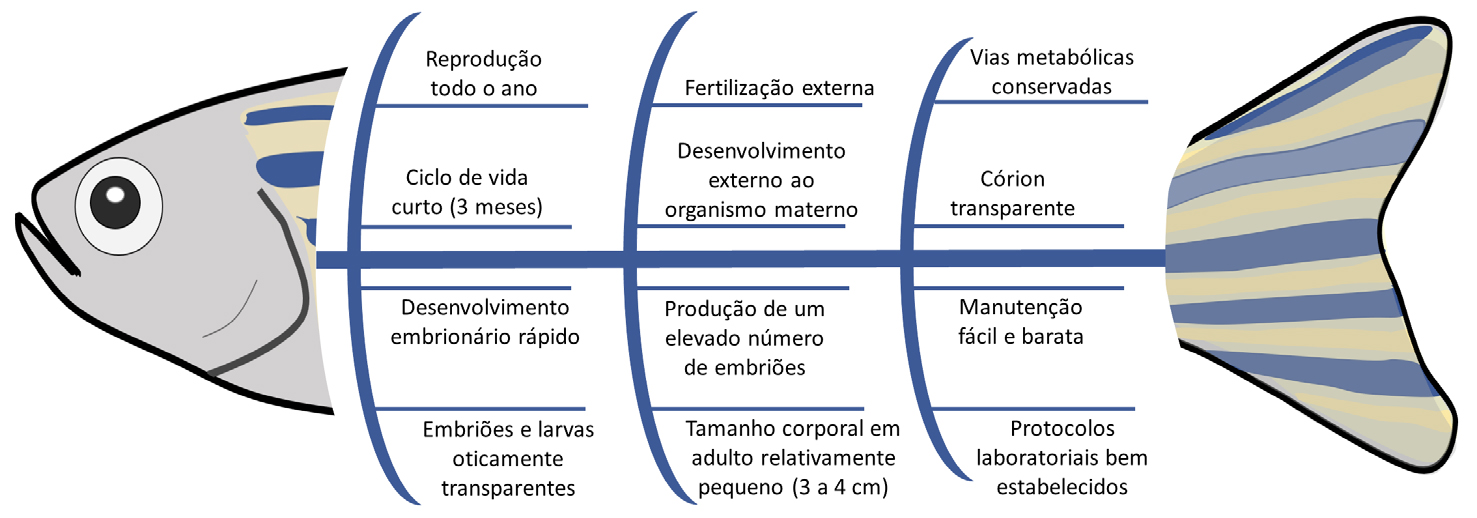
e que pode ser realizada de forma automatizada71. Adicionalmente, existem outras vantagens para a utilização desta espécie como organismo
modelo na investigação, como detalhado na FIGURA 1 e discutido em estudos anteriores31,
51. O genoma do peixe-zebra foi completamente sequenciado e compartilha elevada homologia
genética com os vertebrados superiores, exibindo um grande número de características
genéticas comuns a outros vertebrados33. Aproximadamente 70% dos genes humanos têm
pelo menos um gene ortólogo no peixe-zebra, o que evidencia uma importante semelhança
genética entre as duas espécies. Adicionalmente, as vias de desenvolvimento são conservadas
entre o peixe-zebra e o ser humano72, tornando-o particularmente sensível a compostos
que podem causar efeitos teratogénicos. Estas características destacam a adequação do
peixe-zebra como um modelo experimental para estudar os efeitos de substâncias tóxicas
e sua potencial influência no desenvolvimento embrionário. Apesar das vantagens do peixe-zebra como organismo modelo na investigação serem
muitas e aumentarem com o avanço da manipulação genética, também existem algumas
limitações/desvantagens ao seu uso e que devem ser consideradas. O peixe-zebra é ovíparo e os embriões desenvolvem-se externamente, ao contrário dos
organismos placentários como os mamíferos23. Isto faz com que a exposição aos compostos
seja diferente (exposição direta versus indireta), o que pode levar a variações na taxa de
absorção, distribuição, metabolização e capacidade de ativação do tóxico no peixe-zebra em
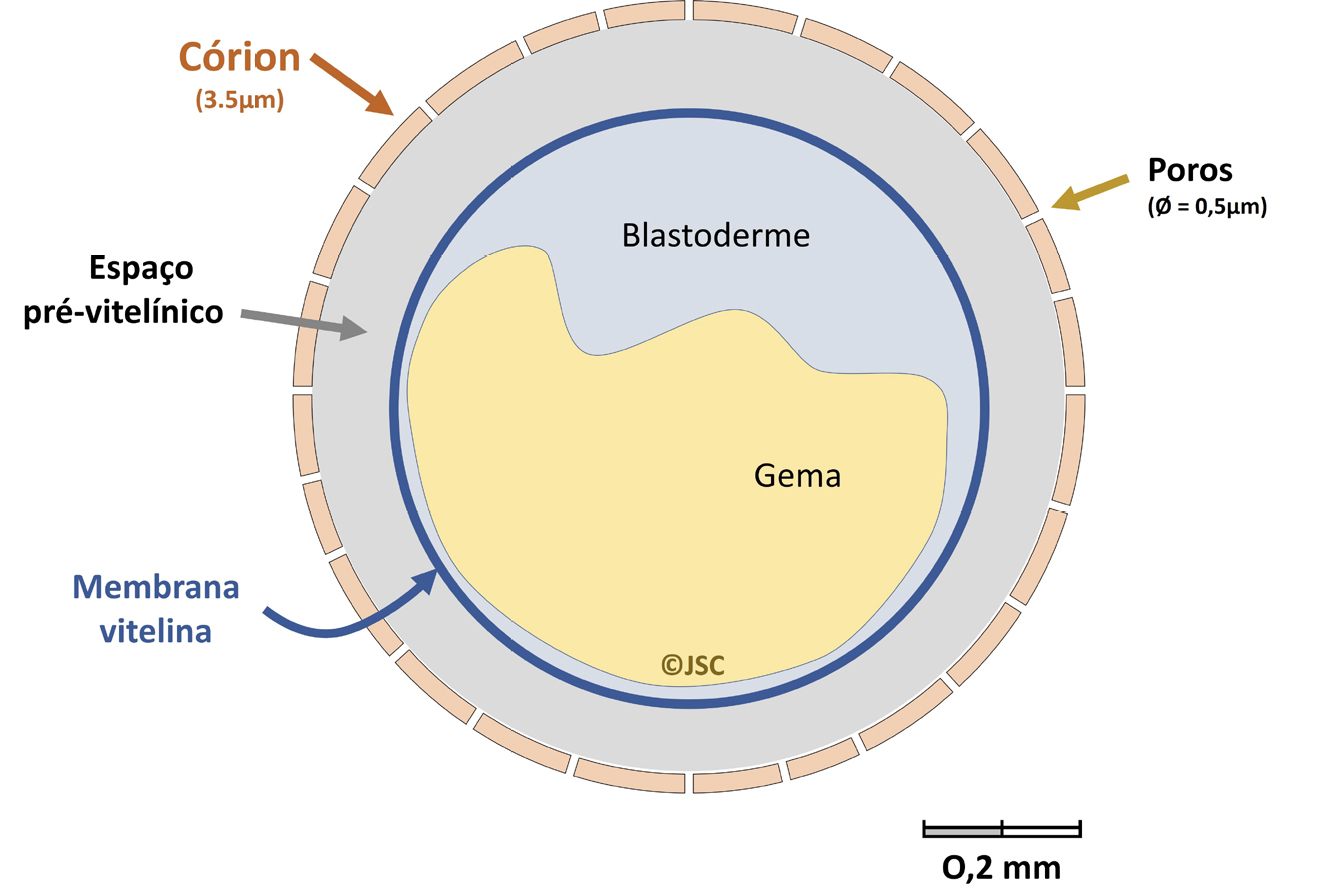
comparação com os mamíferos65. Adicionalmente, a presença do córion (FIGURA 2) até às
48 ou 72 horas após-fertilização38 confere uma barreira contra substâncias tóxicas com tamanho
molecular superior a 3000 Da, o que pode dificultar a sua entrada e a exposição do
embrião. Esta característica pode ser muito útil pois é possível fazer a desinfeção dos ovos
antes do início dos ensaios ou antes da sua transferência para outros centros de investigação,
permitindo uma melhor segurança sanitária minimizando a transferência de parasitas,
bactérias, vírus ou fungos37, 70. Esta espécie é evolutivamente mais distante em relação ao Homem do que outros organismos
vulgarmente usados como espécies modelo, como por exemplo os roedores40. Além
disso, não possui alguns órgãos e estruturas comparativamente aos humanos, como por
exemplo pulmões, membros, articulações, septo cardíaco, entre outros, o que dificulta a sua
utilização em algumas áreas de investigação. Adicionalmente, a determinação sexual do peixe-
zebra também difere dos mamíferos, uma vez que esta espécie não possui um cromossoma
que define o sexo do organismo e possuem um mecanismo de determinação sexual
altamente complexo3, 32. Teratogénese A teratologia é a ciência que estuda as alterações nos mecanismos subjacentes ao desenvolvimento
de um embrião ou feto, podendo traduzir-se em modificações estruturais (malformações
congénitas) nos organismos vivos. Na maioria dos casos pode estar associada à ação de
um agente químico (por exemplo, medicamentos, substâncias psicoativas, tóxicos, entre outros)
ou físico (por exemplo, radiação). As definições de teratogénese podem incluir alterações
bioquímicas, malformações, além de defeitos subtis no comportamento, memória e aprendizagem20.
Assim, torna-se importante a avaliação dos efeitos teratogénicos que os diversos
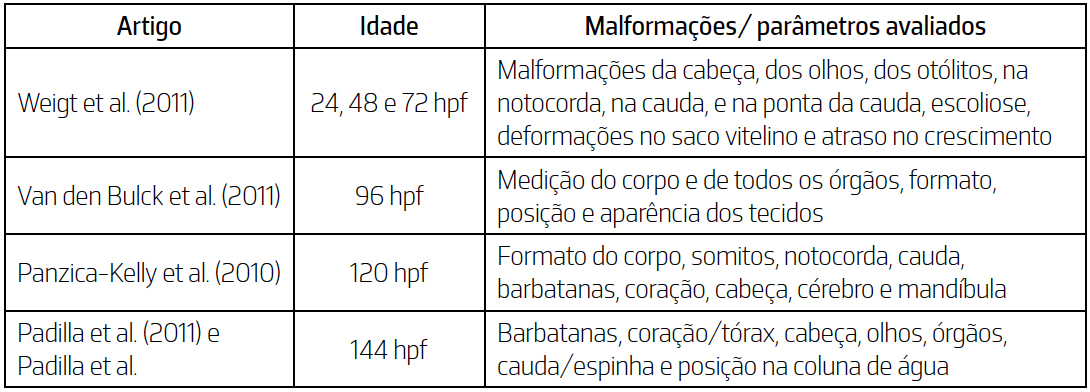
compostos podem exercer ao longo das primeiras fases de desenvolvimento do peixe-zebra. Tipos de malformações em embriões de peixe-zebra. Os ensaios alternativos aos testes de toxicidade de desenvolvimento em animais têm sido
desenvolvidos ao longo dos anos, incluindo o teste de embriotoxicidade em peixe-zebra (Zebrafish
Embryotoxicity Test – ZET). Em 2013 foram adotadas e validadas as diretrizes da Organização
para a Cooperação e Desenvolvimento Económico (OCDE) para o teste de toxicidade
aguda em embriões de peixe (Fish Embryo Acute Toxicity – FET test), o protocolo n.º 236
(OECD, 2013). Este teste encontrou ampla aceitação na comunidade científica como substituto
aos ensaios agudos com juvenis e adultos, e até provou ter maior sensibilidade em relação aos
seres humanos do que outros organismos modelo66. Alguns estudos têm avaliado a importância do uso de peixe-zebra para prever o potencial
teratogénico de numerosos compostos tóxicos12, 45, 56, 63, 66. Estes estudos focam-se essencialmente
em três alterações durante o desenvolvimento anormal do organismo: mortalidade,
malformações e atraso no crescimento56. No entanto, existe uma elevada variabilidade entre os parâmetros avaliados, bem como uma
incoerência na nomenclatura utilizada, o que dificulta a comparação dos resultados entre estudos66.
Assim, torna-se importante padronizar o sistema de classificação para avaliação do
desenvolvimento e malformações dos embriões e larvas de peixe-zebra, de forma a melhorar
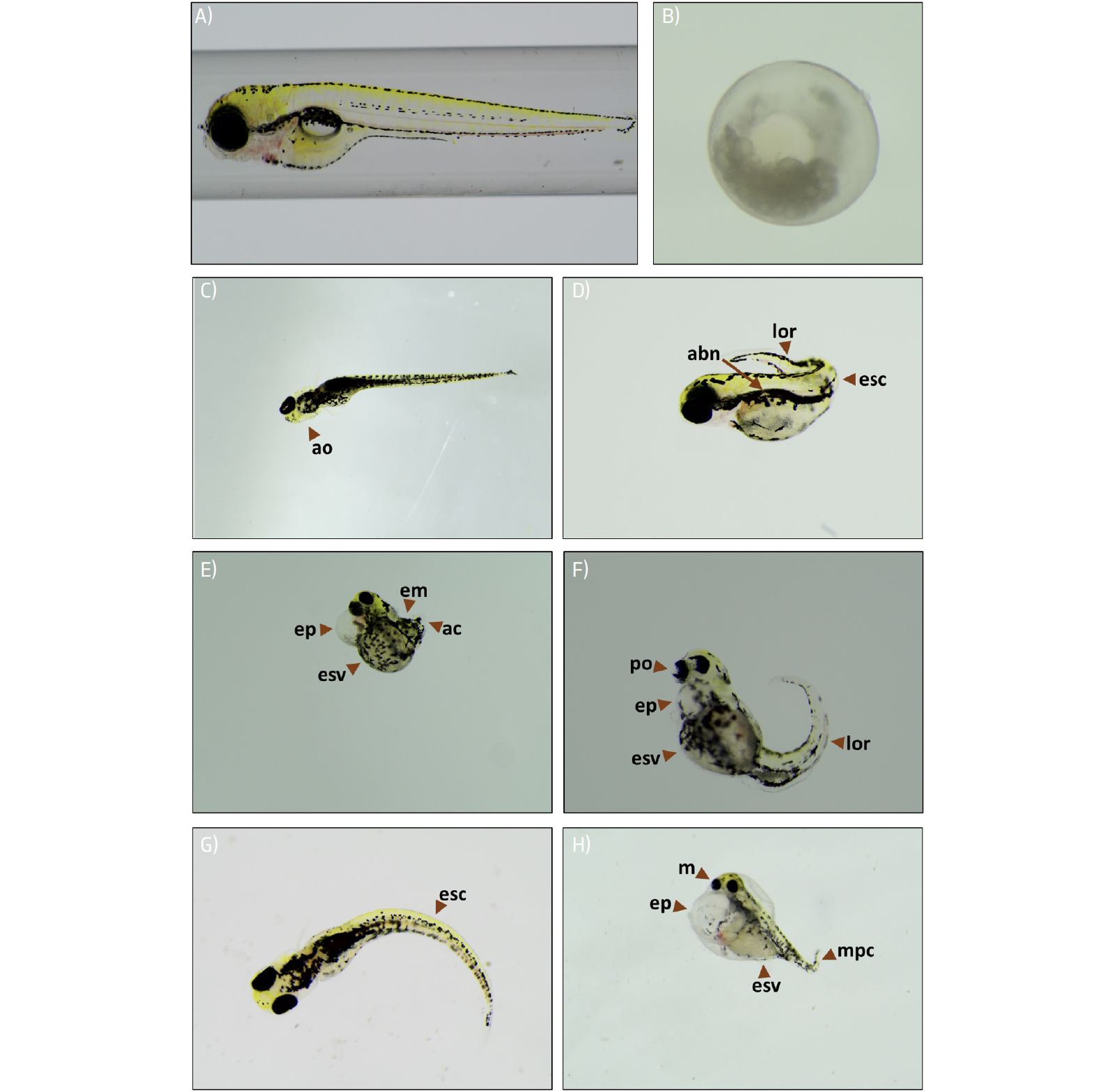
a reprodutibilidade e a comparação entre os diferentes estudos31. Na FIGURA 3, são apresentados exemplos de algumas malformações que podem ser encontradas
em larvas de peixe-zebra. Na TABELA 3 são apresentadas algumas das metodologias utilizadas em diferentes estudos
para a avaliação de malformações e parâmetros específicos em peixe-zebra durante diferentes
fases do desenvolvimento embrionário/larval. Classificação da teratogénese dos compostos. Além da inexistência de padronização do sistema de avaliação dos parâmetros de teratogénese,
muitos estudos não consideram a severidade dos efeitos avaliados. De forma a ultrapassar
este problema, foi proposto um método quantitativo por Brannen et al. (2010)12, com a atribuição
de uma pontuação de severidade aos diversos parâmetros de peixe-zebra. No entanto,
este método foi considerado relativamente trabalhoso e moroso. Panzica-Kelly et al. (2010)50 categorizaram cada parâmetro avaliado entre 5 e 0,5 (diminuição
do valor com o aumento da severidade da malformação), à exceção do formato do corpo
que foi classificado como normal ou anormal. Contudo, esta gradação foi considerada inapropriada
para a análise das malformações nas fases iniciais do desenvolvimento de peixe-zebra,
uma vez que no início do ensaio o córion dos embriões foi removido. Teixidó et al. (2013)63 classificaram
as características morfológicas entre 1 e 4. O valor de 4 foi atribuído a características
desenvolvidas como no período de eclosão, o valor de 3 às características que atingiram
o estágio de desenvolvimento do período faríngeo e o valor de 2 para as características que
mostram um estágio de desenvolvimento como no período de segmentação. Já o valor de 1 foi
atribuído quando as características mostraram uma malformação. Na gradação utilizada por Padilla et al. (2011)49 e Padilla et al. (2012)48 algumas malformações
foram classificadas como presentes ou não (sistema binário) enquanto que outras foram
pontuadas de acordo com a sua severidade de 0 a 4. Após a atribuição das pontuações aos diferentes parâmetros, estes valores são utilizados
para definir se o composto testado é considerado teratogénico ou não, através de um índice de
teratogénese. De uma forma mais simplista, Padilla et al. (2011)49 e Padilla et al. (2012)48 fizeram apenas
a soma dos valores de forma a obter um índice de malformações, sem qualquer definição de
outros resultados. Quanto maior o valor do índice (máximo de 34) maior a capacidade de o
composto induzir malformações. Ainda assim, os valores de severidade dos diferentes parâmetros foram utilizados de forma a
obter o CL50 (concentração calculada do composto resultando em 50% de letalidade/mortalidade)
e o CE50 (concentração do composto que induz metade do efeito máximo) para posterior
definição do potencial teratogénico de um composto através do índice de teratogénese. Este índice é obtido através do quociente entre CL50/CE50. Um composto com um índice superior a 1
é considerado teratogénico, enquanto que índices inferiores a 1 definem o composto como não
teratogénico induzindo maioritariamente efeitos embrioletais/embriotóxicos59, 63, 68. A proporção CL50/CE50 é considerada pouco apropriada, uma vez que mesmo que os efeitos
sejam observados em pontos de tempo anteriores, se o CL50 e/ou CE50 não forem atingidos no
período de exposição, os compostos são automaticamente classificados como não teratogénicos.
Desta forma, os estudos de Panzica-Kelly et al. (2010)50, Hermsen et al. (2011)31 e Beekhuijzen
et al. (2015)10 definem o CL25 (concentração calculada do composto resultando em 25% de
letalidade/mortalidade) e o nível sem efeitos adversos observáveis (NSEAO – do inglês no-observed
effect level (NOEL), e obtém o índice de teratogénese através do quociente entre CL25/
NSEAO. Compostos com índice superior a 10 são classificados como teratogénicos enquanto
que compostos com índices inferiores a 10 são classificados como não teratogénicos. Considerações finais. O peixe-zebra é um modelo animal alternativo e complementar para a substituição do uso de
roedores e outros modelos vertebrados, nomeadamente para o estudo de desenvolvimento
embrionário. O embrião (semitransparente) é considerado um bom modelo para a avaliação
dos potenciais efeitos tóxicos de substâncias teratogénicas, embora apresente diferenças e limitações
em relação ao desenvolvimento embrionário dos roedores. Apesar do aumento considerável
da sua utilização na investigação do desenvolvimento embrionário, verificou-se uma
elevada variação entre os parâmetros avaliados nos diferentes estudo, bem como nomenclaturas
diferente para malformações semelhantes. No entanto, o estudo de embriões de D. rerio
é importante cumprindo com o princípio Redução/Substituição (é também um alternativa aos
testes agudos realizados com juvenis e adultos), com a legislação em vigor (DL: 113/2013) e a
preocupação da comunidade em geral, dos organismos e entidades oficiais que regulam e estudam
este tema. Agradecimentos. Este trabalho é apoiado por Fundos Nacionais através da FCT – Fundação para a Ciência e a
Tecnologia, no âmbito do projeto UIDB/04033/2020 (CITAB/INOV4AGRO) e PTDC/CTA-
-AMB/6686/2020 (ENANTIOTOX). Ondina Ribeiro agradece à FCT pelo financiamento através da bolsa de doutoramento (Ph.D.
2022.12242.BD).
Referências
- 1 ABREU, M. S. et al., Zebrafish as a model of neurodevelopmental disorders, Neuroscience, 445: 3-11. 2020.
- 2 ADHISH, M. & MANJUBALA, I., Effectiveness of zebrafish models in understanding human diseases—A review of models, Heliyon, 9(3): e14557. 2023.
- 3 AHARON, D. & MARLOW, F. L., Sexual determination in zebrafish, Cellular and Molecular Life Sciences, 79: 1-19. 2022.
- 4 AUGUSTINE-RAUCH, K. et al., In vitro developmental toxicology assays: A review of the state of the science of rodent and zebrafish whole embryo culture and embryonic stem cell assays, Birth Defects Research Part C: Embryo Today: Reviews, 90(2): 87-98. 2010.
- 5 BAILEY, J., OLIVERI, A. & LEVIN, E. D., Zebrafish model systems for developmental neurobehavioral toxicology, Birth Defects Research Part C: Embryo Today: Reviews, 99(1): 14-23. 2013.
- 6 BAILONE, R. L. et al., Zebrafish as an alternative animal model in human and animal vaccination research, Laboratory animal research, 36: 1-10. 2020.
- 7 BANDMANN, O. & BURTON, E. A., Genetic zebrafish models of neurodegenerative diseases, Neurobiology of disease, 40(1): 58-65. 2010.
- 8 BAUER, B., MALLY, A. & LIEDTKE, D., Zebrafish embryos and larvae as alternative animal models for toxicity testing, International Journal of Molecular Sciences, 22(24): 13417. 2021.
- 9 BAUMANS, V., The aspects of the use of rodents in experimental research, In Rodent Model as Tools in Ethical Biomedical Research, 7-12: Springer. 2016.
- 10 BEEKHUIJZEN, M. et al., From cutting edge to guideline: A first step in harmonization of the zebrafish embryotoxicity test (ZET) by describing the most optimal test conditions and morphology scoring system, Reproductive Toxicology, 56: 64-76. 2015.
- 11 BIGLOU, S. G. et al., An overview of the insulin signaling pathway in model organisms Drosophila melanogaster and Caenorhabditis elegans, Peptides, 145: 170640. 2021.
- 12 BRANNEN, K. C. et al., Development of a zebrafish embryo teratogenicity assay and quantitative prediction model, Birth Defects Research Part B: Developmental and Reproductive Toxicology, 89(1): 66-77. 2010.
- 13 BRAUNBECK, T. et al., Towards an alternative for the acute fish LC50 test in chemical assessment: the fish embryo toxicity test goes multi-species-an update, ALTEX-Alternatives to animal experimentatio,n 22(2): 87-102. 2005.
- 14 BRIGGS, J. P., The zebrafish: a new model organism for integrative physiology, American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 282(1): R3-R9. 2002.
- 15 BRITO, R. S. et al., Transgenic zebrafish (Danio rerio) as an emerging model system in ecotoxicology and toxicology: Historical review, recent advances, and trends, Science of The Total Environment, 848: 157665. 2022.
- 16 BRYDA, E. C., The Mighty Mouse: the impact of rodents on advances in biomedical research, Missouri medicine, 110(3): 207. 2013.
- 17 CHOE, S.-K. & KIM, C.-H., Zebrafish: A Powerful Model for Genetics and Genomics, Vol. 24, 8169: MDPI. 2023.
- 18 CHOI, T.-Y. et al., Zebrafish as an animal model for biomedical research, Experimental & Molecular Medicine, 53(3): 310-317. 2021.
- 19 COMMISSION, E., Council Directive 86/609/EEC of 24 November 1986 on the approximation of laws, regulations and administrative provisions of the Member States regarding the protection of animals used for experimental and other scientific purposes, Official Journal of the European Union, 358: 1-28. 1986.
- 20 CONLEY, J. M. & RICHARDS, S. M., Teratogenesis. In Encyclopedia of Ecology, 3528-3536. 2008.
- 21 CROUZIER, L. et al., Use of zebrafish models to boost research in rare genetic diseases, International Journal of Molecular Sciences, 22(24): 13356. 2021.
- 22 CSENKI, Z. et al., Microinjection based zebrafish embryo test for the detection of estrogenic substances in slurry based irrigation water and its combined application with yeast estrogen screen, Agricultural Water Management, 272: 107830. 2022.
- 23 D’AMORA, M. & GIORDANI, S., The utility of zebrafish as a model for screening developmental neurotoxicity, Frontiers in neuroscience, 12: 976. 2018.
- 24 DAI, Y. J. et al., Zebrafish as a model system to study toxicology, Environmental Toxicology and Chemistry, 33(1): 11-17. 2014.
- 25 DUBEY, A. et al., Zebrafish as An Emerging Model: An Important Testing Platform for Biomedical Science, Journal of Pharmaceutical Negative Results, Volume 13(3): 2. 2022.
- 26 ERICSSON, A. C. et al., A brief history of animal modeling, Missouri medicine, 110(3): 201. 2013.
- 27 FRANCO, N. H., Animal experiments in biomedical research: a historical perspective, Animals, 3(1): 238-273. 2013.
- 28 GAMBLE, J. T. et al., The zebrafish xenograft models for investigating cancer and cancer therapeutics, Biology, 10(4): 252. 2021.
- 29 GERLAI, R., Zebrafish (Danio rerio): A Newcomer With Great Promise in Behavioral Neuroscience, Neuroscience & Biobehavioral Reviews: 104978. 2022.
- 30 HAMM, J. T. et al., Characterizing sources of variability in zebrafish embryo screening protocols, ALTEX-Alternatives to animal experimentation, 36(1): 103-120. 2019.
- 31 HERMSEN, S. A. et al., Relative embryotoxicity of two classes of chemicals in a modified zebrafish embryotoxicity test and comparison with their in vivo potencies, Toxicology in Vitro, 25(3): 745-753. 2011.
- 32 HOLBECH, H. et al., Detection of endocrine disrupters: evaluation of a Fish Sexual Development Test (FSDT), Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 144(1): 57-66. 2006.
- 33 HOWE, K. et al., The zebrafish reference genome sequence and its relationship to the human genome, Nature, 496(7446): 498-503. 2013.
- 34 JARQUE, S. et al., Morphometric analysis of developing zebrafish embryos allows predicting teratogenicity modes of action in higher vertebrates, Reproductive Toxicology, 96: 337-348. 2020.
- 35 JENNINGS, B. H., Drosophila – a versatile model in biology & medicine, Materials Today, 14(5): 190-195. 2011.
- 36 KALUEFF, A. V. et al., Gaining translational momentum: more zebrafish models for neuroscience research, Vol. 55, 1-6: Elsevier. 2014.
- 37 KENT, M. L. et al., Toxicity of chlorine to zebrafish embryos, Diseases of Aquatic Organisms, 107(3): 235-240. 2014.
- 38 KIMMEL, C. B. et al., Stages of embryonic development of the zebrafish, Developmental dynamics, 203(3): 253-310. 1995.
- 39 KNIGHT, A., Scientific and educational animal use, In Routledge Handbook of Animal Welfare, 161-175: Routledge. 2022.
- 40 LARDELLI, M., Using zebrafish in human disease research: some advantages, disadvantages and ethical considerations, In Proceedings of 2008 ANZCCART Conference, Auckland, New Zealand, 23-28. 2008.
- 41 LEE-ESTEVEZ, M. et al., Zebrafish as a useful model for immunological research with potential applications in aquaculture, Reviews in Aquaculture, 10(1): 213-223. 2018.
- 42 LEE, S. H. et al., Teratogenic Potential of Antiepileptic Drugs in the Zebrafish Model, BioMed Research International, 2013: 726478. 2013.
- 43 LIESCHKE, G. J. & CURRIE, P. D., Animal models of human disease: zebrafish swim into view, Nature Reviews Genetics, 8(5): 353-367. 2007.
- 44 MEEKER, N. D. & TREDE, N. S., Immunology and zebrafish: spawning new models of human disease, Developmental & Comparative Immunology, 32(7): 745-757. 2008.
- 45 NAGEL, R., DarT: The embryo test with the Zebrafish Danio rerio--a general model in ecotoxicology and toxicology, Altex, 19: 38-48. 2002.
- 46 OECD, Test No. 236: Fish Embryo Acute Toxicity (FET) Test, OECD Guidelines for the Testing of Chemicals, Section 2, OECD Publishing, Paris. 2013.
- 47 OLSSON, I. A. S. et al., Protecting animals and enabling research in the European Union: An overview of development and implementation of directive 2010/63/EU, ILAR journal, 57(3): 347-357. 2017.
- 48 PADILLA, S. et al., Zebrafish developmental screening of the ToxCast™ Phase I chemical library, Reproductive Toxicology, 33(2): 174-187. 2012.
- 49 PADILLA, S. et al., Assessing locomotor activity in larval zebrafish: Influence of extrinsic and intrinsic variables, Neurotoxicology and Teratology, 33(6): 624-630. 2011.
- 50 PANZICA-KELLY, J. M. et al., Morphological score assignment guidelines for the dechorionated zebrafish teratogenicity assay, Birth Defects Research Part B: Developmental and Reproductive Toxicology, 89(5): 382-395. 2010.
- 51 RAGHUNATH, A. & PERUMAL, E., Analysis of lethality and malformations during zebrafish (Danio rerio) development, Teratogenicity testing: methods and protocols, 337-363. 2018.
- 52 REHBERGER, K. et al., In vitro or not in vitro: a short journey through a long history, Environmental Sciences Europe, 30(1): 1-12. 2018.
- 53 RIBEIRO, O. et al., Effects of acute metaphedrone exposure on the development, behaviour, and DNA integrity of zebrafish (Danio rerio), Environmental Science and Pollution Research, 1-10. 2023.
- 54 RIBEIRO, O. M. et al., O peixe-zebra (Danio rerio) como modelo emergente na ecotoxicologia, Revista de Ciência Elementar, 10(2). 2022.
- 55 RUSSELL, W. M. S. & BURCH, R. L., The principles of humane experimental technique, Methuen. 1959.
- 56 SÁNCHEZ-OLIVARES, M. A. et al., Toxicity and teratogenicity in zebrafish Danio rerio embryos exposed to chromium, Latin american journal of aquatic research, 49(2): 289-298. 2021.
- 57 SCHAUPP, C. M. et al., Comparison of in silico, in vitro, and in vivo toxicity benchmarks suggests a role for ToxCast data in ecological hazard assessment, Toxicological Sciences, 195(2): 145-154. 2023.
- 58 SCHUBERT, S. et al., Microinjection into zebrafish embryos (Danio rerio)-a useful tool in aquatic toxicity testing?, Environmental Sciences Europe, 26(1): 1-8. 2014.
- 59 SELDERSLAGHS, I. W. et al., Feasibility study of the zebrafish assay as an alternative method to screen for developmental toxicity and embryotoxicity using a training set of 27 compounds, Reproductive Toxicology, 33(2): 142-154. 2012.
- 60 STOLETOV, K. & KLEMKE, R., Catch of the day: zebrafish as a human cancer model, Oncogene, 27(33): 4509-4520. 2008.
- 61 STREISINGER, G. et al., Production of clones of homozygous diploid zebra fish (Brachydanio rerio), Nature, 291(5813): 293-296. 1981.
- 62 TANGUAY, R. L., The rise of zebrafish as a model for toxicology, Toxicological Sciences, 163(1): 3-4. 2018.
- 63 TEIXIDÓ, E. et al., Assessment of developmental delay in the zebrafish embryo teratogenicity assay, Toxicology in Vitro, 27(1): 469-478. 2013.
- 64 VALLE, S. et al., Exploiting oxidative phosphorylation to promote the stem and immunoevasive properties of pancreatic cancer stem cells, Nature Communications, 11(1): 5265. 2020.
- 65 VAN DEN BULCK, K. et al., Zebrafish developmental toxicity assay: A fishy solution to reproductive toxicity screening, or just a red herring?, Reproductive Toxicology, 32(2): 213-219. 2011.
- 66 VON HELLFELD, R. et al., Adverse effects in the fish embryo acute toxicity (FET) test: a catalogue of unspecific morphological changes versus more specific effects in zebrafish (Danio rerio) embryos, Environmental Sciences Europe, 32: 1-18. 2020.
- 67 WAGNER, M. et al., Endocrine disruption and in vitro ecotoxicology: Recent advances and approaches, In vitro Environmental Toxicology- Concepts, Application and Assessment, 1-58. 2017.
- 68 WEIGT, S. et al., Zebrafish (Danio rerio) embryos as a model for testing proteratogens, Toxicology, 281(1): 25-36. 2011.
- 69 WHITE, R. M. et al., Transparent adult zebrafish as a tool for in vivo transplantation analysis, Cell stem cell, 2(2): 183-189. 2008.
- 70 WINN, A. A. et al., Testing alternative surface disinfection agents for zebrafish (Danio rerio) embryos, Journal of the American Association for Laboratory Animal Science, 60(5): 510-518. 2021.
- 71 ZHAO, Y. et al., A review of automated microinjection of zebrafish embryos, Micromachines, 10(1): 7. 2018.
- 72 ZON, L. I. & PETERSON, R. T., In vivo drug discovery in the zebrafish, Nature reviews Drug discovery, 4(1): 35-44. 2005.
Este artigo já foi visualizado 825 vezes.



