Modelos análogos
Crescimento de cristais
📧 , 📧 , 📧
- * Escola Básica de Freiria
- ɫ Escola Básica de Freiria
- ‡ Escola Básica de Freiria
Referência Reis, M. J. E., Sousa, R. M., Santos, S. R., (2021) Modelos análogos, Rev. Ciência Elem., V9(3):057
DOI http://doi.org/10.24927/rce2021.057
Palavras-chave Modelos análogos, modelado cársico, calcário, carbonato, cálcio, grutas, cavernas, circulação, água, dissolução, estalactites, estalactites, calcite, carbonatação, meteorização química
Resumo
O presente trabalho apresenta três atividades experimentais a desenvolver com alunos do 7.º ano, Ciências Naturais e/ou 11.º ano de Biologia e Geologia, com graus de profundidade e enquadramento distintos, que pretendem simular processos análogos aos que ocorrem na Natureza, nomeadamente o desenvolvimento de cristais em grutas e outras cavidades e espaços vazios, cársicos, quer sob a forma de estalactites e estalagmites, quer em solução aquosa. Para o efeito foram utilizadas substâncias químicas que habitualmente existem nos laboratórios das escolas (borato de sódio, sulfato de potássio e alumínio e bicarbonato de sódio). Descreve-se o modo como decorreram as atividades e os resultados obtidos, concluindo-se que as soluções de borato de sódio e de bicarbonato de sódio poderão ser utilizadas para demonstrar o processo de formação de cristais de calcite nas cavidades cársicas, enquanto a solução de sulfato de potássio e alumínio será mais indicada para simular o desenvolvimento de cristais em meio aquoso. Destaca-se a importância da utilização de modelos análogos no ensino da geologia.
Em maio de 2017, no âmbito da ação de formação “Geologia, uma ciência alicerçada na Física e na Química”, fomos desafiadas a desenvolver atividades práticas que integrassem as referidas ciências. O documento “Aprendizagens essenciais” emanado pelo Ministério da Educação prevê que “os alunos se assumam como agentes ativos na construção do seu próprio conhecimento, pesquisando e organizando informação, analisando e interpretando dados, planificando e executando atividades práticas”, sendo que “as atividades práticas devem ser valorizadas e consideradas como parte integrante e fundamental dos processos de ensino e de aprendizagem em todas as temáticas”. Nesse sentido desenvolvemos e testámos três atividades experimentais, destinadas a alunos do 7.º ano, Ciências Naturais e/ou 11.º ano de Biologia e Geologia, para implementar em sala de aula. Com estas pretendemos simular processos análogos aos que ocorrem na Natureza, nomeadamente o desenvolvimento de cristais em cavidades cársicas, quer em ambiente aéreo sob a forma de estalactites e estalagmites, quer em solução aquosa (FIGURA 1). Optámos por escolher substâncias químicas que existem habitualmente nos laboratórios das escolas e que permitam analogias a substâncias associadas aos processos naturais de geodinâmica externa, em estudo.
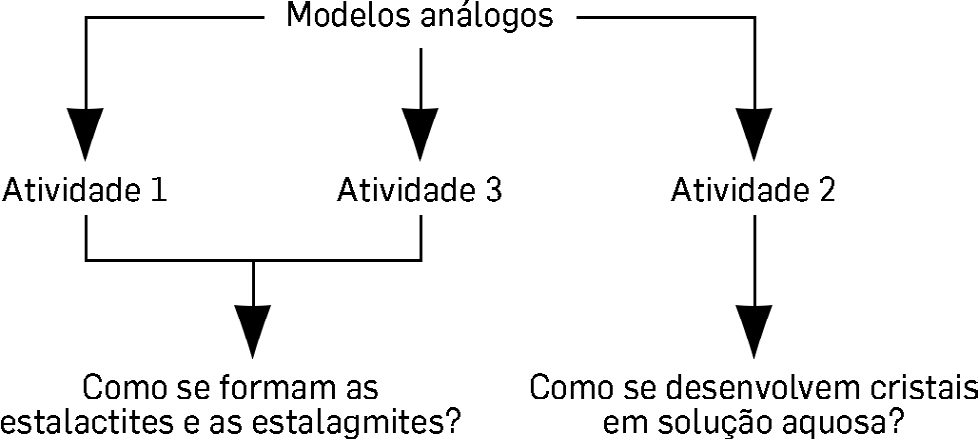
Formação das grutas calcárias, das estalactites e das estalagmites
Os calcários são fundamentalmente formados por um mineral chamado calcite, CaCO3 - carbonato de cálcio.
É a ação química das águas enriquecidas em dióxido de carbono que circulam nas zonas subterrâneas dos maciços calcários que, ao longo de milhões de anos, provoca a formação de galerias e cavidades que constituem as grutas – carbonatação (meteorização química) (FIGURA 2).
CaCO3 (calcite) + H2CO3 (ácido carbónico) ⇌ Ca2+ + 2HCO3¯ (ião hidrogenocarbonato ou bicarbonato)
Como resultado desta reação surge bicarbonato de cálcio dissolvido na água. Em determinadas circunstâncias, como mudanças de pressão e/ou de temperatura por exemplo, os iões precipitam originando as estalactites e as estalagmites.
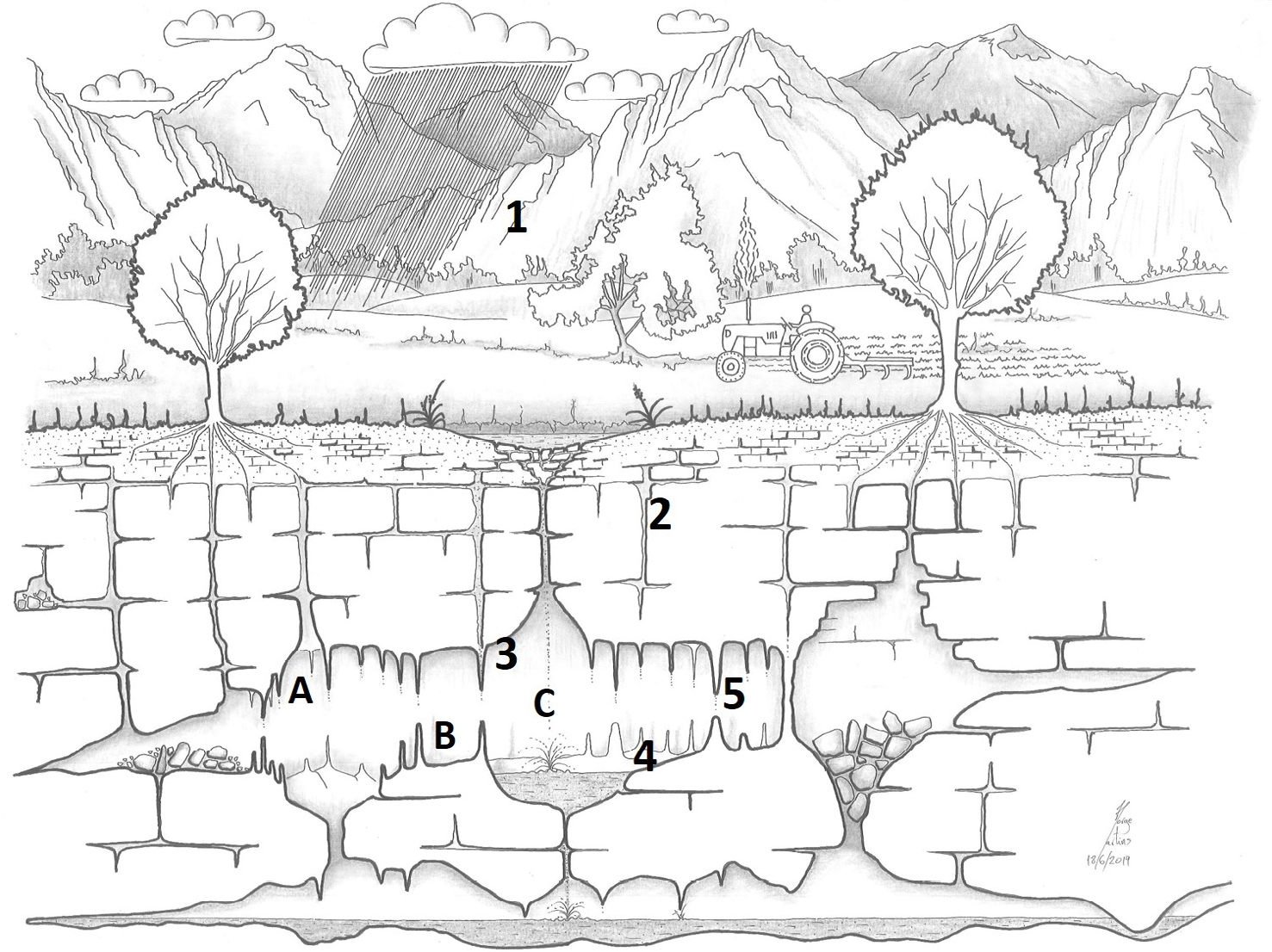
- Quando chove, a água da chuva dissolve o dióxido de carbono existente na atmosfera e forma um ácido fraco (ácido carbónico). A acidez da água pode ser potenciada pelos ácidos húmicos resultantes da percolação da água na manta morta (secção superficial do solo em que as folhas, raízes e restante matéria orgânica existem em abundância em climas temperados).
- A lenta circulação das águas aciduladas, pelas fendas, leva à dissolução do calcário (calcite).
- As águas em circulação subterrânea contêm hidrogenocarbonato de cálcio Ca(HCO)2 em solução. Quando ficam saturadas, ocorre a precipitação de calcite podendo levar à formação das estalactites (A).
- A contínua circulação da água leva a que os pingos ao caírem no fundo da gruta, precipitem o carbonato de cálcio e se deposite a calcite, formando sucessivas camadas que dão origem às estalagmites (B).
- Quando as estalactites e as estalagmites se unem, formam uma coluna, processo que pode demorar de muitos milhares a milhões de anos.
H2O + CO2 ⇋ H2CO3
H2CO3 + CaCO3 ⇌ Ca(HCO3)2
Ao longo do tempo as fendas vão alargando e às vezes formam largos e longos canais subterrâneos onde há circulação da água (rios subterrâneos). As zonas mais alargadas correspondem às cavidades cársicas (cavernas, lapas, …) (C).
Ca(HCO3)2 ⇋ CaCO3 + H2O + CO2
Procedimento Experimental
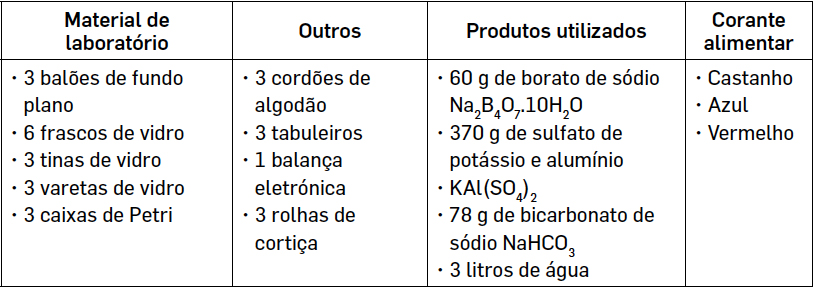
As soluções 1, 2 e 3 foram preparadas com base em tabelas de solubilidade e garantiu-se a sua saturação: 1 - borato de sódio; 2 - sulfato de potássio e alumínio e 3 - bicarbonato de sódio.

Solução 1 - observámos a formação de cristais em meio aquoso, no cordão e na caixa de Petri;
Solução 2 - observámos a formação de cristais essencialmente em meio aquoso e alguns no cordão e na caixa de Petri;
Solução 3 - observámos a formação de cristais no cordão e na caixa de Petri.
Discussão dos resultados
As soluções correm por adsorção ao longo do cordão verificando-se, à medida que a água evapora, a formação de cristais, por precipitação, no cordão, no fundo do frasco e na caixa de Petri.
Nas soluções 1 e 3, o crescimento de cristais ao longo do cordão e na caixa de Petri, pode constituir um modelo análogo à formação dos cristais de calcite (estalactites, estalagmites, travertinos, tufos calcários) nas grutas dos maciços calcários ou em locais onde possam circular águas ricas em carbonato de cálcio. As soluções 1 e 3 são as melhores para demonstrar esse processo.
Nas soluções 1 e 2, os sais dissolvidos na água cristalizam à medida que a solução se torna sobressaturada pela evaporação da água. Este crescimento de cristais dentro da solução poderá ser análogo à formação de cristais de selenite, como os existentes na gruta de Naica, no México1.
Nota: deve-se utilizar cordão de algodão/fibras naturais. Com os cordões sintéticos corre- se o risco de não haver adsorção; devem-se utilizar corantes de cor clara o que permitirá observar mais facilmente o crescimento de cristais na solução.
Considerações finais
- A formação e desenvolvimento de cristais, quer em laboratório quer na natureza, implicam determinadas condições do meio. Os principais fatores externos que condicionam a formação dos cristais são a agitação do meio, o espaço disponível e a temperatura. A variação da temperatura/humidade ambiente poderá alterar a velocidade com que ocorre o processo, tal como na Natureza.
- Foi possível simular em laboratório, num curto intervalo de tempo (cerca de um mês) e de forma simples, a formação de cristais.
- Procurou-se, através das atividades experimentais apresentadas, estabelecer a analogia com a formação de estalactites e estalagmites das paisagens cársicas e com o desenvolvimento de grandes e espetaculares cristais, em condições particulares.
- Este tipo de atividade permite implementar um Domínio de Autonomia Curricular (DAC), opção curricular de trabalho interdisciplinar e articulação curricular, pois possibilita fazer a interseção de aprendizagens essenciais das disciplinas de ciências naturais, física e química e outras. Proporciona aos alunos a oportunidade de utilizar o método científico para pesquisar o mundo natural. Com base nas aprendizagens essenciais das disciplinas, será possível explorar diferentes percursos pedagógico-didáticos, em que se irá privilegiar o trabalho prático, o uso de ferramentas colaborativas online, o desenvolvimento das capacidades de pesquisa e análise, de forma a tornar as aprendizagens mais significativas. Podem ser explorados os conceitos de fórmula química de um sal ou os conceitos de reação química, solução saturada, evaporação e precipitação, meteorização química das rochas, carbonatação, etc..
- Consideramos muito importante que desde cedo os alunos aprendam a relacionar as várias Ciências de forma holística e que interiorizem que, para estudar processos da natureza, precisam de recorrer a várias áreas do conhecimento científico.
Referências
- 1 ANDRADE, G. P., Ensino da Geologia, temas didáticos, Universidade Aberta, Lisboa, 75. 1991.
- 2 DIAS DA SILVA, A. et al., Terra, Universo de Vida Geologia, Porto Editora, Porto, 208. 2018.
- 3 GALOPIM DE CARVALHO, A. M., Ciências Naturais: geologia, Ano propedêutico, Ministério da Educação, Secretaria de Estado do Ensino Superior, Direção Geral do Ensino Superior, Lisboa, 463. 1978.
- 4 GALOPIM DE CARVALHO, A. M., Geologia – morfogénese e sedimentogénese, Universidade Aberta, Lisboa, 189. 1996.
- 5 CLEAVE, J. V., Ciências da Terra para Jovens: 101 Experiências Fáceis de Realizar, Col. Ciência para Jovens, Lisboa, Gradiva. 1993.
- 6 https://www.dge.mec.pt/sites/default/files/Curriculo/Aprendizagens_Essenciais/3_ciclo/ciencias_naturais_3c_7a_ff.pdf, acesso em julho de 2020.
Este artigo já foi visualizado 3312 vezes.



