pH
📧
- Universidade do Porto
Referência Corrêa, C., (2013) pH, Rev. Ciência Elem., V1(1):030
DOI http://doi.org/10.24927/rce2013.030
Palavras-chave pH; química; soluções; Sorensen;
Resumo
Tanto em Química como na vida corrente é muitas vezes necessário exprimir quantitativamente a acidez e a basicidade de soluções de um modo fácil, de preferência por um simples número.
Assim, em 1909 o bioquímico dinamarquês Sorensen, para medir a acidez de soluções aquosas diluídas, introduziu uma grandeza denominada pH, que quantifica a maior ou menor quantidade de H+(aq) existente por litro de solução, através da relação
pH = -log10 [ H+ (aq) ][ H+ (aq) ] = 10-pH .
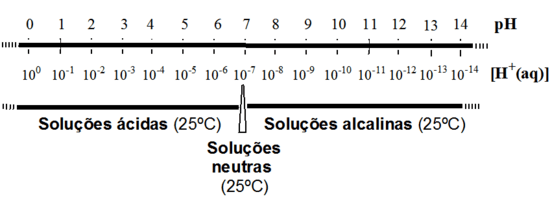
A escala de pH foi introduzida para simplificar a escrita de concentrações expressas por números muito pequenos. Assim, em vez de [ H+ (aq) ] = 0,000025 mol.dm-3 ou 2,5 x 10-5 mol.dm-3, é mais prático escrever pH = 4,60.
A 25 ºC, soluções com pH < 7 dizem-se ácidas e soluções com pH > 7 dizem-se alcalinas ou básicas; as soluções neutras, a 25 ºC, têm pH = 7,0.
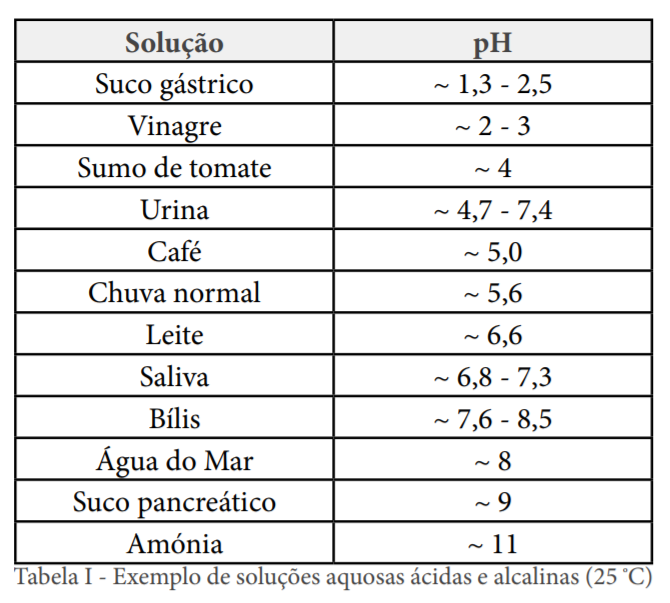
Em soluções aquosas diluídas (até cerca de 0,1 mol\cdotdm-3), a acidez é tanto maior quanto maior for [ H+ (aq) ].
Para soluções mais concentradas, em que a abundância de moléculas de água para solvatar os iões H+ é mais escassa, os iões H+ encontram-se menos ligados a moléculas de água e a acidez do meio (capacidade para doar protões) é superior e não pode ser medida pelo pH. Por esta razão é vulgar apresentar-se a escala de pH compreendida entre 0 e 14, pois dada a relação
[ H+ (aq) ] x [ HO- (aq) ] = 10-14 (25 ºC)
se [ H+ (aq) ] = 1 mol.dm-3 = 100 mol.dm-3, vem pH = 0. Se [ HO– (aq) ] = 1 vem [ H+ (aq) ] = 10-14 mol.dm-3 e pH = 14.
O pH é medido utilizando elétrodos de vidro, que deixam de dar resultados aceitáveis quando [ H+ (aq) ] e [ HO– (aq)] se tornam superiores a 0,1 mol.dm-3 (pH fora do intervalo 1 - 13).
Na definição rigorosa de pH, em vez de concentração, utiliza-se a atividade, \(a_{\text{H}^+}\)
A atividade é uma grandeza termodinâmica que se torna igual à concentração em soluções bastante diluídas. A acidez e a alcalinidade de soluções de ácidos e de bases muito concentrados é medida por outras funções de acidez, com as Funções de Acidez de Hammett.
Este artigo já foi visualizado 5285 vezes.



