Prémio Nobel da Química 2014
📧
- Universidade de Aveiro
Referência Claro, P.R., (2014) Prémio Nobel da Química 2014, Rev. Ciência Elem., V2(4):064
DOI http://doi.org/10.24927/rce2014.064
Palavras-chave Prémio; Nobel; Química;
Resumo
O Prémio Nobel da Química de 2014 foi atribuído a Eric Betzig, do Instituto Médico Howard Hughes (EUA), Stefan Hell, do Instituto Max Planck (Alemanha), e a William Moerner, da Universidade de Stanford (EUA), pelo “desenvolvimento da microscopia de super-resolução por fluorescência”.
É este o parágrafo padrão que a maioria das agências noticiosas utilizou para divulgar ao mundo a decisão do Comité Nobel. Mas o que está para além da descrição sintética apresentada pelo Comité para justificar a atribuição, o tal “desenvolvimento da microscopia de super-resolução por fluorescência”? Que informação adicional poderemos dar aos nossos alunos em sala de aula, ao amigo que quer desenvolver o tema, ou num texto para a Ciência Elementar?
A verdade é que não vale a pena tentar “reinventar a roda”! Ao longo dos anos, o Comité Nobel foi aperfeiçoando a qualidade do seu trabalho de comunicação de ciência. E vale a pena aproveitar os recursos que são atualmente fornecidos pelo comité Nobel na sua página oficial. A qualidade é excelente e fornece diversos níveis de abordagem: o anúncio do prémio, com a descrição sucinta do trabalho premiado; o comunicado de imprensa, com informação destinada a ser reproduzida nos meios de comunicação social; a informação popular, incluindo uma descrição mais detalhada e figuras ilustrativas de grande qualidade comunicacional; e a informação avançada, com uma descrição mais aprofundada das bases científicas do trabalho premiado.
O texto que se segue é uma tradução livre do comunicado de imprensa (http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2014/press.html) que contém uma explicação rigorosa mas acessível para o cidadão comum interessado – um texto que, felizmente, foi bastante bem reproduzido em vários meios de comunicação social. E como “uma (boa) imagem vale mais do que mil palavras”, não devemos perder as ilustrações disponibilizadas.
“Durante muitos anos, a microscopia viveu com uma suposta limitação: a de que nunca seria possível obter uma resolução melhor que metade do comprimento de onda da luz visível. Com a ajuda de moléculas fluorescentes, os Laureados de 2014 contornaram engenhosamente esta limitação. O seu trabalho inovador trouxe a microscopia ótica para a dimensão nanométrica.

Através daquilo que se tornou conhecido como “nanoscopia”1, os cientistas podem visualizar os percursos de moléculas individuais dentro das células vivas; podem ver como as moléculas criam sinapses entre células nervosas no cérebro; podem seguir as proteínas envolvidas na doença de Parkinson, Alzheimer e Huntington à medida que estas se agregam; podem seguir as proteínas individuais em óvulos fertilizados enquanto estes se dividem para gerar embriões.
Era tudo menos óbvio que os cientistas alguma vez seriam capazes de estudar células vivas no mais ínfimo detalhe molecular. Em 1873, o microscopista Ernst Abbe estipulou um limite físico para a resolução máxima de microscopia ótica tradicional: ela nunca poderia se tornar melhor do que 0,2 micrometros2 . Eric Betzig , Stefan W. Hell e William E. Moerner são agraciados com o Prémio Nobel de Química 2014 por terem ultrapassado esse limite. Devido ao seu contributo, o microscópio ótico agora pode perscrutar o mundo nano.
São recompensados dois princípios distintos. Um é o método de microscopia por depleção da emissão estimulada (STED - stimulated emission depletion), desenvolvido por Stefan Hell em 2000. O método utiliza dois feixes de laser: um estimula as moléculas fluorescentes para brilhar, o outro anula toda a fluorescência que ocorra fora de um volume em escala nanométrica. O varrimento completo da amostra, nanometro a nanometro, produz uma imagem com uma resolução superior ao limite estipulado de Abbe.
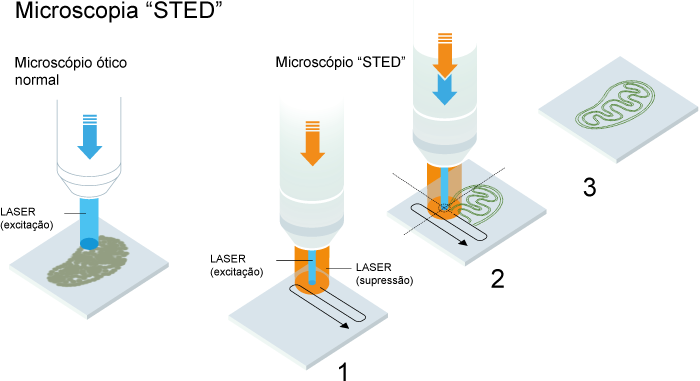
Eric Betzig e William Moerner, trabalhando separadamente, lançaram as bases para o segundo método, a microscopia de molécula única (single molecule microscopy). O método baseia-se na possibilidade de ligar ou desligar a emissão de fluorescência de moléculas3. A imagem da mesma área é obtida várias vezes, deixando apenas algumas moléculas intercaladas brilhar de cada vez. A sobreposição dessas imagens produz uma super-imagem de elevada densidade, com resolução à escala nanométrica . Eric Betzig utilizou este método pela primeira vez em 2006.”


Notas do autor
- Embora o Comité Nobel tenha preferido a designação de “microscopia de super-resolução” na descrição do trabalho premiado, o termo nanoscopia é também utilizado com frequência. Neste caso, o termo aplica-se com alguma propriedade: se o microscópio permite ver estruturas cuja dimensão é da ordem dos micrómetros (10-6 m), então o nanoscópio permite ver até à dimensão (de perto) do nanometro (10-9 m).
- O “limite de Abbe”, tal como referido no texto, depende do comprimento de onda da luz utilizada no microscópio ótico. Considerando que os comprimentos de onda da luz visível estão entre os 700 nm (vermelho) e os 400 nm (violeta), o limite de Abbe é de 0,15-0,25 μm no visível (sendo inferior a 0,15 μm na região do ultra-violeta). A referência no texto a 0,2 micrometros é, assim, uma simplificação totalmente aceitável.
- “A descoberta e o desenvolvimento de proteínas fluorescentes” - as proteínas que estão na base do método de microscopia de molécula única de Betzig e Moerner - foi objeto do prémio Nobel da Química em 2008. Nesse ano, o comunicado de imprensa do comité Nobel já destacava o potencial desta “marcação luminosa” para a observação de processos celulares.
Paulo Ribeiro Claro
Departamento de Química,
Universidade de Aveiro
Este artigo já foi visualizado 3234 vezes.



