Raio iónico
📧
- Faculdade de Ciências da Universidade do Porto
Referência Fernandes, R.F., (2014) Raio iónico, Rev. Ciência Elem., V2(1):130
DOI http://doi.org/10.24927/rce2014.130
Palavras-chave Raio iónico; núcleo; catião; anião;
Resumo
O raio iónico corresponde à medida do raio de um ião num composto cristalino iónico, considerando-se que os iões apresentam forma esférica. A distância entre o núcleo do catião e do núcleo do anião equivale à soma dos dois raios iónicos (figura 1).
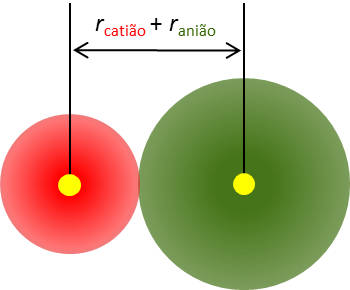
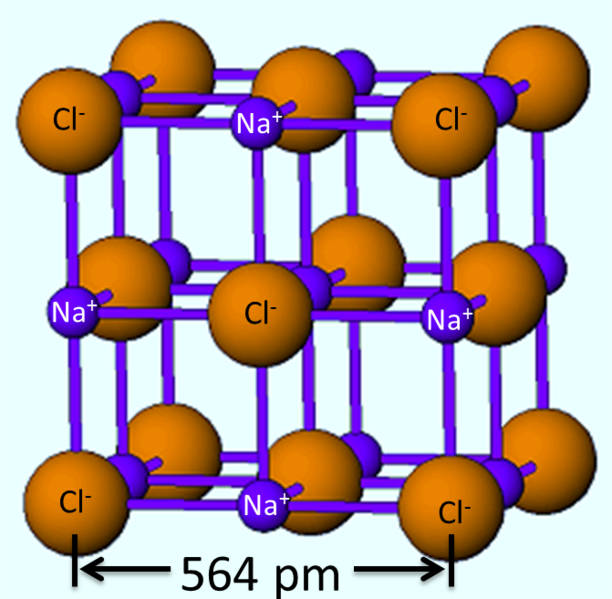
O conceito de raio iónico foi desenvolvido independentemente, em 1920, pelo químico norte-americano Linus Pauling (1901-1994) e pelo químico suíço Victor Goldschmidt (1888-1947), para coligir dados cristalográficos gerados pela técnica de difração de raios-X. Esta técnica fornece o comprimento da unidade de célula de um cristal, porém não distingue a fronteira entre os iões que a compõem. Por exemplo, a célula unitária do cloreto de sódio (NaCl) tem um comprimento de 564 pm (figura 2) o que corresponde ao dobro do raio iónico de cada um dos iões:
\(2 \times [r_{\text{cati} \tilde{a} \text{o} } (\text{Na}^+) + r_{\text{ani} \tilde{a} \text{o}} (\text{Cl}^-) ] = 564 \text{ pm}\)
Por comparação de estruturas cristalográficas de vários compostos iónicos, Linus Pauling, atribuiu o valor de 140 pm ao ião O2-. Deste modo, conhecendo-se o raio de um dos iões, e, sabendo que a soma dos raios iónicos está relacionada com o comprimento da unidade de célula do cristal, pode calcular-se o valor do raio dos outros iões.
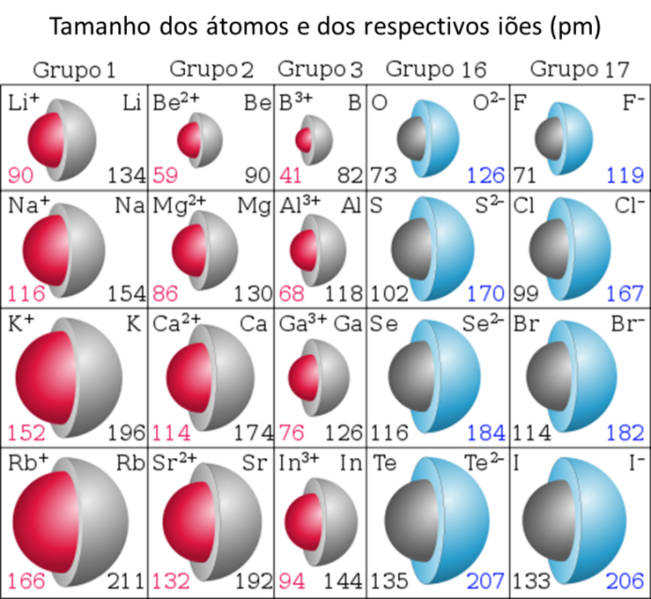
Em geral o raio iónico diminui com o aumento da carga positiva e aumenta com o aumento da carga negativa. Os catiões são sempre mais pequenos que o átomo, devido à diminuição da repulsão eletrão-eletrão. Os aniões são sempre maiores que o átomo, devido à introdução de mais um eletrão na camada de valência, o que provoca um aumento na repulsão eletrão-eletrão, traduzindo-se numa expansão da nuvem eletrónica. Para iões com carga igual, apresenta maior raio iónico aquele que tiver o maior número atómico. O raio iónico, de uma forma semelhante ao raio atómico, é uma propriedade periódica, que aumenta monotonamente ao longo de um grupo e diminui genericamente ao longo de um período. A figura 3 apresenta a variação do raio atómico e do raio iónico para alguns elementos da tabela periódica.
Este artigo já foi visualizado 12499 vezes.



