Solvente
📧
- Faculdade de Ciências da Universidade do Porto
Referência Lima, L.S., (2014) Solvente, Rev. Ciência Elem., V2(1):131
DOI http://doi.org/10.24927/rce2014.131
Palavras-chave Solvente; soluções; sólido; líquido; gasoso;
Resumo
Nas soluções, a substância na qual se dispersa(m) outra(s) designa-se por solvente e todos os outros componentes são designados por solutos. O solvente tem sempre o mesmo estado físico da solução, podendo ser sólido, líquido ou gasoso. Normalmente, é a substância presente em maior quantidade; no caso de soluções em que as substâncias estão presentes em proporções idênticas, considera-se solvente o componente mais volátil, isto é, com menor ponto de ebulição. A água é o solvente mais conhecido e utilizado.
Com base na respetiva polaridade, os solventes podem dividir-se em polares e apolares. A permitividade elétrica relativa (anteriormente designada por constante dielétrica) é uma medida da polaridade de um solvente e é definida como o quociente entre a intensidade do campo elétrico no vazio e no material em questão (neste caso o solvente). Os solventes que tenham um valor de permitividade relativa inferior a 15 classificam-se como apolares. A polaridade das moléculas de solvente (medida pelo momento dipolar) é um fator determinante da sua polaridade. Se as moléculas de solvente forem polares, isto é, se o momento dipolar de cada molécula não for nulo, então o solvente denomina-se polar. Num solvente apolar, as moléculas de solvente possuem um momento dipolar nulo ou próximo de zero. Esta característica permite prever se um solvente consegue dissolver um determinado soluto. Para tal, considera-se frequentemente a regra “semelhante dissolve semelhante”, que significa que solventes polares dissolvem preferencialmente solutos polares e que solventes apolares dissolvem preferencialmente solutos apolares. Apesar de ignorar alguns aspetos envolvidos nas interações soluto-solvente, como a possível formação de ligações de hidrogénio ou a energia envolvida na interação entre as moléculas de soluto e solvente, esta simples regra funciona surpreendentemente bem para um grande conjunto de pares soluto-solvente.
Os solventes polares podem, ainda, classificar-se como próticos e apróticos (ou protogénicos e não-protogénicos de acordo com a recomendação da IUPAC).1,2 Os solventes polares próticos (e.g. água, metanol) têm a capacidade de estabilizar os iões através da cedência de um protão, estabelecendo, assim, uma ponte de hidrogénio, e através da cedência de eletrões não compartilhados. Os solventes polares apróticos (e.g. acetona, tetraidrofurano) não possuem átomos de hidrogénio com uma fraca ligação química, pelo que não podem estabelecer pontes de hidrogénio. Contudo, dado o seu elevado momento dipolar, há uma separação de cargas positivas e negativas dentro de cada molécula, o que faz com que possam estabilizar os iões em solução por interação entra a carga iónica e o dipolo permanente. Esta propriedade é muito importante porque determina o tipo de reações que os iões podem ter em solução. Por exemplo, um solvente prótico favorece a substituição nucleófila unimolecular (SN1), enquanto um solvente aprótico favorece a substituição nucleófila bimolecular (SN2). Estes dois tipos de reação de substituição processam-se através de mecanismos diferentes, pelo que a escolha do solvente para favorecer uma das reações é determinante.
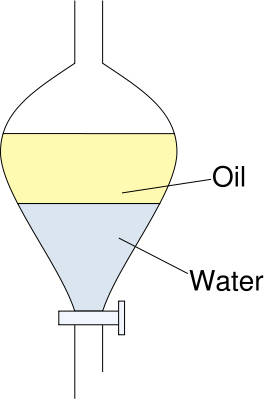
A escolha do solvente mais adequado ao fim pretendido, tem de ter em consideração outras características além das mencionadas, tais como o preço, o ponto de ebulição, a inflamabilidade, a densidade, a toxicidade e/ou o impacto no meio ambiente. O ponto de ebulição do solvente determina a sua velocidade de evaporação. Quanto maior for o ponto de ebulição, menor é a velocidade de evaporação, isto é, menor é a sua volatilidade. Esta propriedade é importante quando se pretende efetuar a separação entre solvente e soluto através de processos como a destilação. Também a densidade é uma propriedade a ter em conta quando, por exemplo, se fazem operações de partição de soluto entre solventes num funil de separação (figura 1). Como regra geral, dentro do número de solventes possíveis, deve escolher-se o menos inflamável, o menos tóxico e com menor impacto ambiental.
Os solventes são muito utilizados nos laboratórios de Química e na indústria e têm as mais variadas aplicações. A extração da cafeína dos grãos de café, por exemplo, pode ser feita através da utilização do dióxido de carbono supercrítico (solvente apolar), a temperaturas acima de 304.2 K (31,1 oC) e pressões acima de 7,4 MPa (73 atm). Nestas condições, o dióxido de carbono dissolve 97 a 99 % da cafeína presente, originando o café “descafeinado”. Posteriormente, a cafeína é recuperada por evaporação do solvente (CO2 gasoso).
Referências
- 1 IUPAC Gold Book: Protogenic (solvent), consultada em 19/05/2010.
- 2 IUPAC Gold Book: Aprotic (solvent), consultada em 19/05/2010.
Este artigo já foi visualizado 8681 vezes.



