Abundância isotópica
📧
- Faculdade de Ciências da Universidade do Porto
Referência Ribeiro, D., (2014) Abundância isotópica, Rev. Ciência Elem., V2(3):219
DOI http://doi.org/10.24927/rce2014.219
Palavras-chave relação; número; abundância isotópica;
Resumo
A abundância isotópica numa amostra é a fração do número de átomos de um dado isótopo de um elemento em relação ao número total de átomos desse elemento presentes na amostra.1
Salvo algumas exceções, os elementos possuem diversos isótopos que surgem na Natureza em diferentes percentagens (ver figura 1). Abundância isotópica natural é a abundância isotópica encontrada na Natureza.1
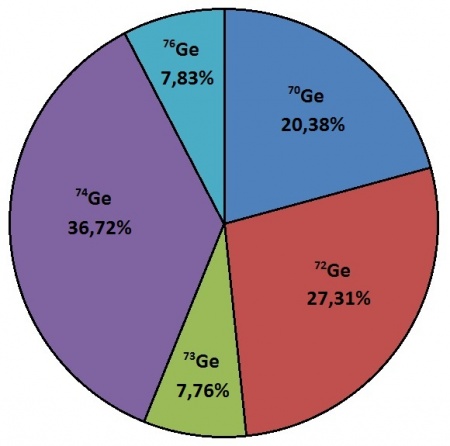
A composição isotópica de um elemento deve indicar a abundância relativa de cada um dos seus isótopos.2 A abundância de um isótopo é um valor necessário para os cálculos de massas atómicas (relativas ou não) de elementos químicos porque a massa atómica é a média pesada das massas isotópicas correspondentes.
Assim, o cálculo de uma massa atómica relativa pode ser dado, matematicamente, por
\(A_r = w(1)\times A_r(1)+w(2)\times A_r(2)+w(3)\times A_r(3)+\cdots\)
em que \(w(i)\) é a abundância relativa do isótopo \(i\) de massa atómica \(A_r(i)\).3 Por exemplo, para o germânio, \({}_{32}\mbox{Ge}\), virá:
\(A_r(\mbox{Ge}) = 0,2038\times 69,9242474+0,2731\times 71,9220758+0,0776\times\)
\(72,9234589+0,3672\times 73,9211778 + 0,0783\times 75,9214026\)
\(\Leftrightarrow A_r(\mbox{Ge}) = 72,64\)
A tabela periódica abaixo pode ser utilizada para consultar os valores das abundâncias isotópicas de diversos isótopos, bem como as massas isotópicas relativas e as massas atómicas relativas de cada elemento químico. Poderá também consultar um arquivo com os dados referidos para todos os elementos químicos aqui.
| 1 | 18 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | 2 | 13 | 14 | 15 | 16 | 17 | He | |||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||
| 3 | Na | Mg | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | Al | Si | P | S | Cl | Ar | |
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| 6 | Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
Referências
- 1 International Union of Pure and Applied Chemistry (IUPAC): Glossary of terms used in nuclear analytical chemistry, consultado em 14/05/2012.
- 2 International Union of Pure and Applied Chemistry (IUPAC): Isotopic compositions of the elements 2009 (IUPAC Technical Report), consultado em 14/05/2012.
- 3 C. Corrêa, F. P. Basto, N. Almeida, Química, 1ª edição, Porto: Porto Editora, 2008, ISBN: 978-972-0-42248-4.
Este artigo já foi visualizado 14410 vezes.



