Número de oxidação
📧
- Faculdade de Ciências da Universidade do Porto
Referência Ribeiro, D., (2014) Número de oxidação, Rev. Ciência Elem., V2(4):276
DOI http://doi.org/10.24927/rce2014.276
Palavras-chave oxidação; eletrões; química; carga; átomo
Resumo
O número de oxidação é um conceito convencional usado em química em variadas situações, inclusive na nomenclatura. O número de oxidação de um elemento em qualquer espécie química é a carga que ficaria no átomo desse elemento se os eletrões em cada ligação formada por esse átomo fossem atribuídos ao átomo mais eletronegativo.1
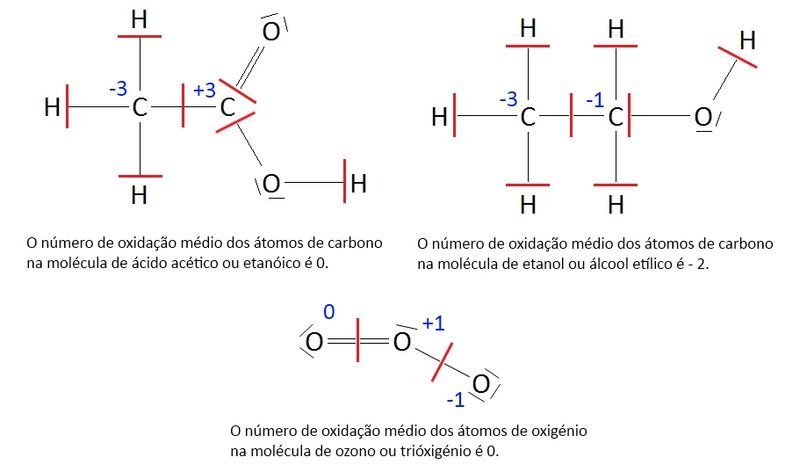
Quando um elemento pode apresentar vários números de oxidação (dependendo da espécie química a que ele pertence) diz-se que se pode encontrar em diferentes estados de oxidação. Em algumas espécies químicas poliatómicas, um elemento pode apresentar átomos com diferentes números de oxidação devido a distribuições assimétricas dos eletrões – ver figura 1 – nesses casos, é usual considerar-se o “número de oxidação médio”.
O estudo mais metódico das reações de oxidação-redução remonta aos tempos da teoria do flogisto, proposta no século XVIII pelo químico alemão Georg Stahl (1659-1734)2, mas foi Antoine-Laurent Lavoisier (1743-1794) quem deu a primeira definição de oxidação em 1772. Em 1907, os químicos Henry Talbot e Arthur Blanchard propuseram um sistema de numeração que definia os diferentes estados de oxidação de um elemento3. O conceito de número de oxidação foi introduzido pelo químico Wendell Latimer, em 1938, com o propósito de identificar as reações de oxidação-redução4. Assim, no caso de reações em que haja variação do número de oxidação, diz-se que se trata de uma reação química de oxidação-redução.
No caso de espécies monoatómicas, o número de oxidação é igual à carga real que o átomo adquiriu quando passou do estado elementar ao estado de oxidação considerado. Assim, o número de oxidação do catião sódio, Na+, é +1, do ião cálcio, Ca2+ é +2, do anião cloreto, Cl-, é -1, do ião sulfureto, S2-, é -2, etc.
No caso de espécies poliatómicas, o número de oxidação de um átomo é a carga formal, isto é, a carga formalmente atribuída a esse átomo se os eletrões, em cada ligação que esse átomo efectua, fossem atribuídos aos átomos mais eletronegativos5. No entanto, no caso de compostos covalentes os átomos não perdem nem adquirem eletrões, apenas os compartilham. Nesses casos, dever-se-á atribuir números de oxidação determinando a carga elétrica que o átomo iria adquirir se os eletrões das ligações covalentes pertencessem exclusivamente aos átomos mais eletronegativos. Considere-se o caso da reação de formação do cloreto de hidrogénio:
\(Cl_2(g) + H_2(g) \longrightarrow 2\ HCl(g)\)
Como o cloro é mais eletronegativo que o hidrogénio e apenas um par de eletrões está envolvido na ligação, diz-se que, na molécula de cloreto de hidrogénio, o hidrogénio possui número de oxidação + 1 e o cloro – 1, pois atribuindo o par de eletrões ao Cl o átomo ficará rodeado por 8 eletrões, mais um do que no estado elementar.
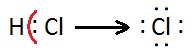
É útil considerar algumas regras para a atribuição de números de oxidação‡ de qualquer átomo numa espécie química5:
- O número de oxidação de um elemento no estado livre ou numa substância elementar (H2, Li, Cl2, S8, Al, por exemplo) é sempre zero.
- O número de oxidação de iões monoatómicos corresponde à carga do respetivo ião.
- O soma algébrica de todos os números de oxidação de todos os átomos numa molécula neutra é igual a zero; no caso de iões, essa soma é igual à carga do ião.
- Em compostos, o número de oxidação dos metais alcalinos é igual a +1, o dos metais alcalino-terrosos é +2, o do alumínio é +3 e o do flúor é -1. Note-se que o flúor é o elemento com a maior eletronegatividade.
- Em compostos, o número de oxidação do hidrogénio é +1 (exceto nos hidretos, que é – 1, como resulta da aplicação das duas regras precedentes).
- Em compostos, o número de oxidação do oxigénio é –2 (exceto nos peróxidos, que é –1, nos superóxidos, que é – ½, e no fluoreto de oxigénio, OF2, que é +2, como resulta da aplicação das regras precedentes).
As regras 4, 5 e 6 devem aplicar-se em conjunto com a regra 3 e por essa ordem. Assim, tomando como exemplo a molécula de ácido pirofosfórico, H3PO4, pode, pela aplicação sucessiva das regras anteriores, determinar-se os números de oxidação dos respetivos átomos:
- Pela aplicação da regra 5, o número de oxidação do hidrogénio é + 1.
- Revendo a regra 6, o número de oxidação do oxigénio é – 2.
- Aplicando a regra 3, o número de oxidação do fósforo é + 5 (porque \(3 \times(+1)+x+4 \times(-2)=0 \Leftrightarrow x=+5\) )
‡ Ou "número de oxidação médio" para um elemento que apresente átomos com diferentes números de oxidação nessa espécie química.
Referências
- 1 F. P. Basto, A. Machado, Nomenclatura de Química Inorgânica – Parte I, 2ª edição, Porto: CIQ(UP)/DQFCUP, 1984, Publicação nº 72.RT8.
- 2 F. J. Moore, A History of Chemistry, 1st edition, New York: McGraw-Hill Book Company, Inc., 1918.
- 3 H. P. Talbot, A. A. Blanchard, The Electrolytic Dissociation Theory with Some of Its Applications, New York: Macmillan, 1907, consultado em 28/11/2011.
- 4 W. B. Jensen, J. Chem. Educ. 84(9) (2007), 1418-1419, consultado em 28/11/2011.
- 5 C. Corrêa, F. P. Basto, N. Almeida, Química no Mundo Real, 1ª edição, Porto: Porto Editora, 2008, ISBN: 978-972-0-42249-1.
Este artigo já foi visualizado 5114 vezes.



