Catalisador
📧
- Faculdade de Ciências da Universidade do Porto
Referência Fernandes, R.F., (2015) Catalisador, Rev. Ciência Elem., V3(2):036
DOI http://doi.org/10.24927/rce2015.036
Palavras-chave catalisador; substância;
Resumo
O catalisador é uma substância que aumenta a velocidade de uma reação, mas não é consumido ao longo desta.
Um catalisador aumenta a velocidade de uma reação química, uma vez que baixa a energia de ativação (Ea) da reação através da alteração do mecanismo reacional, fornecendo assim um caminho alternativo que evita o passo lento que determina a velocidade da reação não catalisada (Figura 1). Note-se que um catalisador apesar de modificar o mecanismo de uma reação, não afeta a variação da energia de Gibbs (ΔG) da reação global, dado que a energia de Gibbs é uma função de estado. Logo, uma reação termodinamicamente desfavorável não passará a ser favorável pela introdução de um catalisador. Uma outra característica importante de um catalisador é a sua seletividade, ou seja, a capacidade que o catalisador tem de formar uma quantidade elevada do produto de reação pretendido, limitando ao mínimo os outros produtos da reação. Apesar de um catalisador não ser consumido no decorrer da reação, acaba por ir perdendo a sua atividade, uma vez que, durante os ciclos catalíticos, vai sendo progressivamente destruído em reações secundárias.
De acordo com a fase em que o catalisador se encontra, classifica-se como heterogéneo, quando se encontra numa fase diferente da dos reagentes, ou homogéneo, quando está na mesma fase que os reagentes. Os catalisadores heterogéneos são em geral sólidos, resistentes a temperaturas elevadas e têm a vantagem de serem facilmente separáveis dos produtos de reação. Os catalisadores homogéneos têm como vantagem uma elevada seletividade, porém, como estão na mesma fase que os produtos de reação, torna-se difícil separá-los, conduzindo à sua perda.
A natureza química dos catalisadores e a sua aplicação catalítica é muito diversa. No entanto, é possível fazer algumas generalizações. Os iões H+ são usados como catalisadores, sobretudo, para reações que envolvam grupos OH (água, álcoois, etc.), incluindo a hidrólise e esterificação. Os metais de transição (vanádio, crómio, ferro, níquel, ruténio) são frequentemente usados para catalisar reações de oxidação-redução. Nos processos catalíticos que envolvam hidrogénio, a platina é o metal que, geralmente, está sempre presente, como por exemplo, na hidrogenação de alcenos. A nível biológico, as reações bioquímicas são catalisadas por proteínas globulares, denominadas enzimas. Devido à sua estrutura tridimensional, as enzimas apresentam locais específicos, designados por centros ativos, onde a molécula reativa, substrato, se encaixa. Esta é uma situação análoga à de uma chave (o reagente) que apenas funciona com uma determinada fechadura (enzima). Deste modo, apenas moléculas específicas, ou partes específicas de moléculas com uma forma particular, se encaixam no centro ativo da enzima e ficam temporariamente ligados. Estas propriedades levam a que se usem enzimas como catalisadores na síntese de compostos orgânicos, processo denominado biocatálise.
Um catalisador é uma substância introduzida num sistema reacional com o objetivo de aumentar a velocidade da reação. No entanto, existem substâncias que diminuem a velocidade de uma reação química, sendo designadas por inibidores. Em contraste com os catalisadores, os inibidores são consumidos no decorrer da reação.
Existem casos em que as reações químicas são autocatalisadas, uma vez que um dos produtos formados atua como catalisador. Assim, no decurso destas reações a quantidade de catalisador vai aumentando o que promove o aumento (de forma não linear) da velocidade de reação. No entanto, na fase final da reação a velocidade vai diminuindo à medida que os reagentes se vão esgotando.
No quotidiano os catalisadores estão presentes em variadíssimas situações, desde os processos industriais e processos bioquímicos que ocorrem nos organismos até às reações que ocorrem na atmosfera, como por exemplo, a destruição do ozono (O3) na estratosfera. Neste último processo, o ozono (O3) é destruído pelos átomos de cloro (Cl) provenientes dos clorofluorcarbonetos (CFC) existentes na estratosfera. a formação de átomos de cloro (Cl) a partir da quebra da ligação C-Cl por ação da luz ultravioleta na molécula de triclorofluorometano (CFCl3):
\(CFCl_3 + hν \rightarrow CFCl_2 + Cl\)
O átomo de cloro (Cl) assim libertado atua como iniciador de uma reação química (via radicais livres) com as moléculas de O3 existentes na estratosfera, estabelecendo-se o seguinte ciclo catalítico (reação em cadeia):
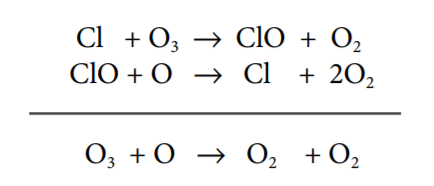
Deste modo, os átomos de cloro (Cl) atuam como iniciadores e catalisadores, estando disponíveis no final de cada ciclo para novas reações. Assim, um único átomo de Cl pode destruir milhares de moléculas de O3, conduzindo à diminuição da quantidade de ozono presente na estratosfera.
Na atualidade, os catalisadores têm uma grande importância económica nos processos industriais, estimando-se que 90% de todos os produtos químicos produzidos envolvam a utilização de um catalisador em algum dos seus estágios de produção. O desenvolvimento de novos catalisadores, tem permitido que as reações sejam não só mais rápidas, mas também mais limpas e menos consumidoras de energia, o que torna os processos cada vez mais ecológicos e económicos.
Referências
- 1 http://goldbook.iupac.org/C00876.html, consultado em 10/01/2010.
- 2 http://goldbook.iupac.org/I03035.html, consultado em 10/01/2010.
- 3 http://antoine.frostburg.edu/chem/senese/101/glossary/c.shtml, consultado em 10/01/2010.
- 4 http://scienceworld.wolfram.com/chemistry/Catalyst.html, consultado em 10/01/2010.
- 5 http://en.wikipedia.org/wiki/Enzyme, consultado em 10/01/2010.
Este artigo já foi visualizado 13310 vezes.