Monossacarídeos
📧
- Faculdade de Ciências da Universidade do Porto
Referência Brás, N., (2015) Monossacarídeos, Rev. Ciência Elem., V3(1):081
DOI http://doi.org/10.24927/rce2015.081
Palavras-chave Monossacarídeos; açúcar; biomoléculas;
Resumo
Definição e Fundamentos básicos
Os monossacarídeos (oses) são os açúcares simples, sendo geralmente cristalinos, doces e solúveis em água, de fórmula estrutural [C(H2O)]n, onde n > 2. Quimicamente estes compostos possuem diversos grupos hidroxilo (-OH), podendo ser poli-hidroxialdeídos (aldoses) ou poli-hidroxicetonas (cetoses), dependendo do grupo funcional que contêm, aldeído ou cetona, respetivamente. Os monossacarídeos são moléculas não hidrolisáveis e redutoras (grupos aldeído e cetona podem sofrer oxidação), sendo classificadas de acordo com o número de átomos de carbono. O gliceraldeído (aldotriose) e a di-hidroxiacetona (cetotriose) são os monossacarídeos mais pequenos com apenas 3 átomos de carbono (C3H6O3). No entanto, as oses mais comuns e importantes nos seres vivos são as aldo-pentoses e as aldo-hexoses com 5 e 6 átomos de carbono, respetivamente. As pentoses D-ribose (C5H10O5) e a D-desoxiribose (C5H10O4) são constituintes básicos dos ácidos nucleicos RNA e DNA, respetivamente, sendo essenciais à vida. As hexoses que se destacam pela sua importância são a D-glicose, D-frutose, D-manose e D-galactose, que obedecem à fórmula de estrutura geral C6H12O6 e são as principais fontes de energia dos seres vivos (Figura 1). Estas biomoléculas são ricas em energia, constituindo os principais combustíveis celulares. O monossacarídeo mais abundante é a D-glicose, que se encontra presente no mel, uvas e outros frutos, assim como no sangue.
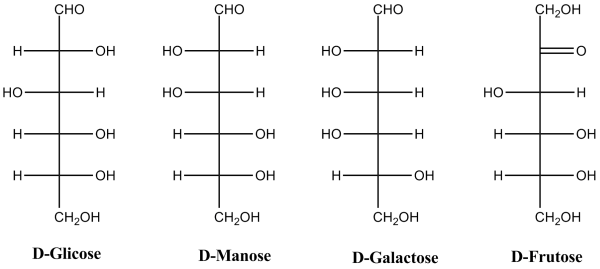
A D-glicose e outros monossacarídeos são naturalmente sintetizados através da fotossíntese, em quantidade estimada de 100 mil milhões de toneladas por ano a partir de CO2, H2O e energia luminosa. Este processo de absorção de energia solar é a forma privilegiada de reserva e obtenção de energia nos seres vivos, estando a reação geral representada na Figura 2.
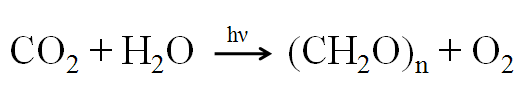
Desenvolvimento avançado
Com a exceção da di-hidroxiacetona, todos os glícidos possuem um ou mais centros quirais (átomo de carbono assimétrico), originando 2n estereoisómeros, em que n é o nº de carbonos assimétricos da molécula, que apresentam diferentes conformações. Em solução, estes compostos provocam a rotação diferenciada do plano de oscilação da luz polarizada, designando-se por enantiómeros. O único centro quiral do gliceraldeído possibilita a existência de dois enantiómeros, designados D-gliceraldeído (grupo hidroxilo (-OH) do carbono anomérico orientado para a direita) e L-gliceraldeído (grupo -OH do carbono anomérico orientado para a esquerda). Em geral, os enantiómeros dos restantes monossacarídeos são classificados como tipo D ou L, por comparação do grupo -OH do carbono quiral mais distante do grupo carbonilo com a do grupo -OH do carbono anomérico do gliceraldeído. Os seres eucariotas apenas possuem enantiómeros D, sendo também os mais abundantes nos procariotas. Alguns monossacarídeos são muito semelhantes, diferindo apenas na conformação quiral de um carbono, designando-se por epímeros, tal como por exemplo a D-glucose e a D-galactose que apenas diferem na orientação do grupo –OH do C4.
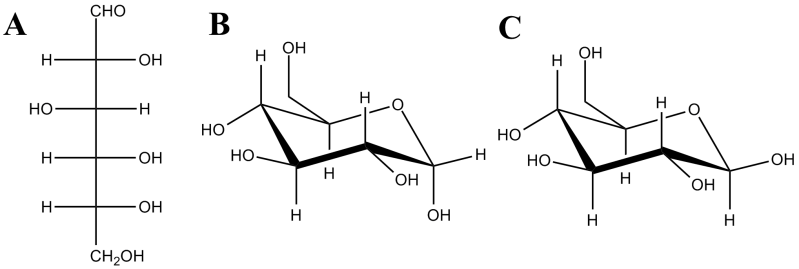
A projeção de Fisher representa a estrutura dos monossacarídeos em cadeias de carbono lineares. No entanto, em solução aquosa, os monossacarídeos com cinco ou seis átomos de carbono tendem a formar estruturas cíclicas, que derivam de uma reação intramolecular entre um hidroxilo e o grupo carbonilo da aldose ou cetose. Os anéis de cinco e seis lados designam-se furanoses e piranoses, respetivamente. As piranoses são mais estáveis em solução e constituem a forma predominante em organismos vivos. Em solução, verifica-se um equilíbrio entre a forma linear e as formas cíclicas, o qual se desloca para as estruturas cíclicas. Estas últimas originam dois novos diastereoisómeros que se designam por anómeros α ou β. Por exemplo, numa solução de D-glicose em equilíbrio estima-se que exista cerca de 99,5% da forma piranose (37,5% de α-D-glicose e 62% de β-D-glicose). Na figura 3 encontram-se representadas a projeção de Fisher da D-glicose e as formas cíclicas das moléculas de α-D-glicose e β-D-glicose. As formas cíclicas não apresentam anéis planos, adotando as conformações em barco ou em cadeira. Embora exista uma pequena percentagem da conformação em barco devido ao equilíbrio rápido entre ambas as formas, a conformação em cadeira é a predominante e mais estável.
Referências
- 1 T. Lindhorst, Essentials of Carbohydrate Chemistry and Biochemistry, First Edition, Wiley-VCH, 2007, ISBN: 978-3-527-31528-4.
- 2 A. Quintas, A. Freire e M. Halpern, Bioquímica – Organização Molecular da Vida, Lidel, 2008 ISBN: 978-972-757-431-5.
- 3 Dicionário Enciclopédico de Português, Editorial Verbo, 2006, ISBN: 978-989-554-244-4.
- 4 http://pt.wikibooks.org/wiki/Bioqu%C3%ADmica/Gl%C3%ADcidos
- 5 http://pt.wikiversity.org/wiki/Introdu%C3%A7%C3%A3o_%C3%A0_Bioqu%C3%ADmica/Constituintes_estruturais_dos_sistemas_vivos/Gl%C3%ADcidos/Monossacar%C3%ADdeos
Este artigo já foi visualizado 12630 vezes.



