Amálgama
📧
- Faculdade de Ciências da Universidade do Porto
Referência Fernandes, R.F., (2015) Amálgama, Rev. Ciência Elem., V3(1):085
DOI http://doi.org/10.24927/rce2015.085
Palavras-chave Amálgama; mercúrio; metais; ferro; platina;
Resumo
Uma amálgama é uma liga metálica obtida a partir da combinação de mercúrio com um ou mais metais. A maioria dos metais, à exceção do ferro e da platina, misturam-se com o mercúrio dando origem a diferentes amálgamas que se apresentam, geralmente, no estado sólido. No entanto, em função das diferentes quantidades dos metais presentes, algumas das misturas obtidas podem estar no estado líquido, consistindo, nesse caso, numa solução de um ou mais metais em mercúrio.
Existem várias opiniões acerca da origem da palavra amálgama, porém pode-se considerar que etimologicamente a palavra amalgama deriva do grego malagma que significa “substância amolecedora ou mole”.
As amálgamas apresentam diferentes utilizações no dia a dia. Por exemplo, a formação de amálgamas com metais preciosos levou que o mercúrio fosse utilizado na extração de ouro e prata, a partir dos respetivos minérios. No século XIX foram utilizadas amálgamas de estanho-mercúrio no revestimento refletor para o fabrico de espelhos.
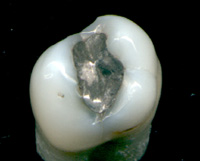
As amálgamas dentárias, liga de prata-mercúrio (figura 1), começaram a ser utilizadas na China por volta do século VII como material para selar as cavidades nos dentes provocadas pelas cáries dentárias. Atualmente, as amálgamas usadas em estomatologia são constituídas por 43 a 54% de mercúrio, 20 a 35% de prata, 10 % de cobre, 2% de zinco e uma pequena percentagem de estanho. Devido à elevada toxicidade dos metais usados na sua conceção, especialmente o mercúrio, aliado ao facto de serem bastante inestéticas, as amálgamas dentárias têm vindo a ser substituídas por novos materiais e em alguns países a sua utilização foi proibida.
Em contraste com o mercúrio no estado líquido ou sob a forma de amálgama, os sais de mercúrio, dado que se dissolvem em água, são muito mais tóxicos. Para detetar a presença de sais de mercúrio em solução pode recorrer-se à formação de uma amálgama de cobre/mercúrio. Para isso, acidifica-se a solução e colocam-se algumas gotas numa placa de cobre (figura 2). O cobre reduz os iões de mercúrio ao estado elementar de acordo com a seguinte equação redox:
Hg2+(aq) + Cu(s) \(\longrightarrow\) Hg(l) + Cu2+(aq)

O mercúrio no estado elementar, em contacto com a placa de cobre, dá origem a uma amálgama cobre/mercúrio que se apresenta sob a forma de pequenas manchas circulares com coloração prateada. Note-se que se a solução a analisar contiver iões de prata (Ag+), estes são reduzidos pelo cobre ao estado elementar, Ag (s), originando pequenos círculos à superfície da placa com forma e coloração semelhante à amálgama cobre/mercúrio. No entanto, os dois tipos de manchas são facilmente distinguíveis, uma vez que aqueles pequenos círculos podem ser removidos sem dificuldade da placa de cobre.
Referências
Este artigo já foi visualizado 7801 vezes.



