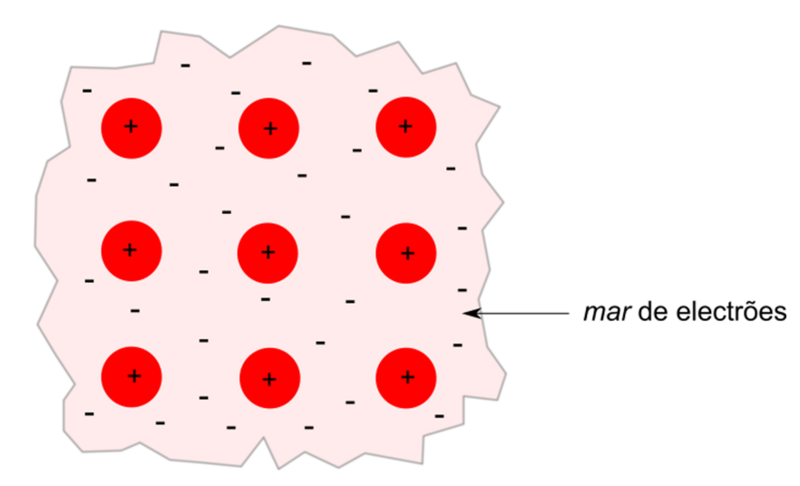
Ligação metálica
📧
- Faculdade de Ciências da Universidade do Porto
Referência Fernandes, R.F., (2015) Ligação metálica, Rev. Ciência Elem., V3(2):139
DOI http://doi.org/10.24927/rce2015.139
Palavras-chave ligação metálica; química; eletrões; catiões;
Resumo
A ligação metálica é uma ligação química que ocorre em metais e ligas metálicas. Considera-se que os átomos da estrutura cristalina do metal se encontram num estado ionizado (catiões) e que os eletrões de valência (frequentemente também designados por eletrões livres) se encontram deslocalizados, formando aquilo que se designa por mar de eletrões. A ligação metálica resulta assim através das interações eletrostáticas atrativas entre os iões positivos e os eletrões deslocalizado (figura 1).
A ideia da formação do mar de eletrões foi proposta, em 1900, pelo físico alemão Paul Drude. Neste modelo, os eletrões de valência apresentam uma elevada mobilidade, não se encontrando ligados a nenhum átomo em particular. A formação do mar de eletrões é explicada pela baixa energia de ionização e baixa eletronegatividade dos metais que facilmente podem formar iões Mn+. Deste modo, os eletrões de valência destes elementos facilmente se podem deslocalizar, criando assim um conjunto de eletrões livres. Porém, esta teoria é uma modelo simplificado que apenas descreve qualitativamente como as ligações ocorrem nos metais, não permitindo explicar de uma forma quantitativa as diferenças nas propriedades dos diversos metais. Posteriormente, com o advento da mecânica quântica, o físico suíço Felix Bloch publicou, em 1928, um trabalho que deu origem à teoria das bandas, que permite a racionalização e previsão das propriedades térmicas, elétricas e magnéticas dos metais.
Os metais apresentam diferentes forças de ligação, que são traduzidas pelas temperaturas de fusão e ebulição. Verifica-se que os elementos metálicos que têm maior número de eletrões de valência, um menor tamanho e maior carga nuclear (número atómico) apresentam temperaturas de fusão e ebulição mais elevadas, indicando assim que nestes elementos as ligações são mais fortes.
As ligações metálicas são responsáveis pelas propriedades características dos metais. A condutibilidade elétrica e térmica é facilmente explicada pela elevada mobilidade dos eletrões deslocalizados que se encontram no mar de eletrões.
A maleabilidade e ductilidade dos metais são explicadas pelo carácter não direcional das ligações entre os iões positivos e o mar de eletrões. Assim, quando se aplica uma força externa à estrutura cristalina de um metal estes eletrões deslocalizados ajustam-se imediatamente à deformação que ocorreu, o que evita a sua fratura.
O aspeto lustroso e brilhante dos metais está relacionado com os eletrões livres do mar de eletrões. A interação da radiação eletromagnética (luz) com os eletrões de valência deslocalizados que se encontram à superfície do respetivo mar de eletrões induz uma oscilação com a mesma frequência da radiação incidente. Esta oscilação leva a que o metal reflita a luz à mesma frequência que o atinge, produzindo assim uma aparência brilhante.
O aspeto lustroso e brilhante dos metais está relacionado com os eletrões livres do mar de eletrões.A interação da radiação eletromagnética (luz) com os eletrões de valência deslocalizados que se encontram à superfície do respetivo mar de eletrões induz uma oscilação com a mesma frequência da radiação incidente. Esta oscilação leva a que o metal reflita a luz à mesma frequência que o atinge, produzindo assim uma aparência brilhante.
A manipulação das ligações entre os átomos dos metais tem aplicações tecnológicas importantes. Os metais no estado puro apresentam geralmente pouca dureza, porém, quando se adiciona outro composto ao metal, criando uma liga metálica, as ligações entre os átomos tornam-se mais fortes dando origem a materiais mais resistentes. Por exemplo, a adição de carbono ao ferro produz uma liga designada por aço, que apresenta ligações metálicas muito mais fortes que o ferro no estado puro. O ouro é um metal que no estado puro (24 quilates; 99,9%) é muito macio, mas quando se encontra num estado menos puro (18 quilates; 75%) apresenta uma maior rigidez.
Referências
- 1 http://chemwiki.ucdavis.edu/Theoretical_Chemistry/Chemical_Bonding/Metalic_Bonding, consultado em 26/03/2010.
- 2 http://www.chem1.com/acad/webtext/chembond/cb10.html, consultado em 26/03/2010.
- 3 http://www.chemguide.co.uk/atoms/bonding/metallic.html#top, consultado em 26/03/2010.
Este artigo já foi visualizado 11396 vezes.