Fórmula química
📧
- Faculdade de Ciências da Universidade do Porto
Referência Fernandes, R.F., (2015) Fórmula química, Rev. Ciência Elem., V3(4):243
DOI http://doi.org/10.24927/rce2015.243
Palavras-chave Química; fórmulas; símbolos;
Resumo
Em Química, as fórmulas consistem num conjunto de símbolos (caracteres, sinais) e algarismos que indicam características estruturais de uma substância.
As fórmulas químicas são escritas utilizando o símbolo do elemento químico (e.g. C, S, Ca), seguido de um algarismo em índice inferior. Esse algarismo (que se omite quando é 1) indica a quantidade relativa ou a proporção molar ou atómica desse elemento presente na substância. Por exemplo, a água apresenta a fórmula química H2O, o que indica que o composto é constituído pelos elementos hidrogénio (H) e oxigénio (O), em que o algarismo 2 que aparece em índice inferior após o hidrogénio indica que este elemento encontra-se numa proporção molar ou atómica de 2:1 em relação ao oxigénio. Note-se que, neste caso o algarismo que segue o oxigénio encontra-se omitido uma vez que corresponde a 1.
As notações das fórmulas químicas foram essencialmente desenvolvidas a partir dos trabalhos do químico sueco Jöns Jakob Berzelius, que é considerado um dos pais da Química moderna. Berzelius, em 1813, recomendou que na notação dos elementos se utilizassem caracteres (letras) em detrimento de determinados símbolos utilizados até então, uma vez que seria muito mais fácil escrever uma palavra abreviada do que desenhar uma figura. Assim, de acordo com Berzelius, o símbolo de um elemento químico corresponderá às iniciais do nome desse elemento em latim, e para descrever substâncias obtidas pela combinação de elementos utilizam-se algarismos para indicar as proporções em que se encontram.
A fórmula empírica é a fórmula química mais simples e expressa a composição de um determinado composto em termos de proporções relativas dos elementos químicos presentes. Por exemplo, a fórmula empírica do benzeno é CH, indicando que neste composto os átomos de carbono (C) e hidrogénio (H) estão na proporção de 1:1. Existem também compostos como, por exemplo, o eteno (C2H4), o buteno (C4H8) e o cicloexano (C6H12) que apesar de terem diferentes fórmulas moleculares, apresentam a mesma fórmula empírica (CH2). As fórmulas empíricas são também utilizadas para expressar a composição de compostos iónicos, dado que nestes compostos não existem moléculas discretas, mas sim redes cristalinas compostas por um grande número de iões. Assim, a composição destes compostos é expressa através da fórmula mais simples possível que indica o número mínimo da proporção necessária de catiões e aniões para obter um composto electricamente neutro (e.g. NaCl, MgCl2,Na2SO4).
A fórmula molecular para além de indicar a composição, indica também o número de átomos existentes numa molécula e não apenas as proporções em que estes se encontram, tal como acontece na fórmula empírica. São exemplos os acima citados eteno (C2H4), buteno (C4H8) e cicloexano (C6H12). No entanto, a fórmula molecular não permite distinguir compostos com composições iguais mas ligados entre si de forma diferente (isómeros estruturais) Por exemplo a fórmula molecular do etanol C2H6O indica que uma molécula é composta por 2 átomos de carbono (C), 6 átomos de hidrogénio e 1 átomo de oxigénio, porém não permite distinguir o etanol do seu isómero estrutural metoximetano ou éter dimetílico (C2H6O). Estes dois compostos diferem nas suas fórmulas de estrutura.
A fórmula de estrutura é uma representação da estrutura molecular que mostra como os átomos se encontram ligados entre si, permitindo distinguir isómeros estruturais. Para os dois isómeros citados, etanol (C2H6O ou C2H5OH) e metoximetano (CH3-O-CH3), as fórmulas de estrutura são:
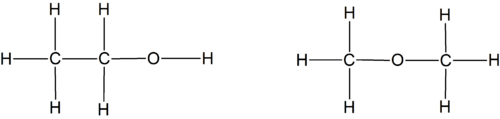
Existem compostos que, apesar de terem a mesma fórmula de estrutura, diferem na posição espacial relativa dos seus átomos. Para os distinguir é necessário utilizar as fórmulas estereoquímicas. Por exemplo, os isómeros cis e trans do 1,2-dicloroetileno apresentam fórmulas estereoquímicas diferentes.

Referências
- 1 http://web.lemoyne.edu/~giunta/berzelius.html, consultado em 29/03/2010.
- 2 http://www.chem1.com/acad/webtext/intro/ST1.html, consultado em 29/03/2010.
Este artigo já foi visualizado 5927 vezes.



