Fórmula empírica
📧
- Faculdade de Ciências da Universidade do Porto
Referência Fernandes, R.F., (2015) Fórmula empírica, Rev. Ciência Elem., V3(4):244
DOI http://doi.org/10.24927/rce2015.244
Palavras-chave átomos; hidrogénio; fórmula;
Resumo
A fórmula empírica de um composto é a fórmula química mais simples possível e indica somente a relação entre o número de átomos de cada espécie. Por exemplo, a glucose apresenta a fórmula empírica CH2O, indicando que no composto, por cada átomo de carbono, existe um átomo de oxigénio e dois átomos de hidrogénio.
A fórmula empírica de um composto é determinada a partir da sua composição elementar. Assim, é necessário conhecer a percentagem mássica de cada elemento presente no composto, que é expressa, de acordo com a equação (1), pelo quociente entre a massa de cada elemento e a massa total da amostra:
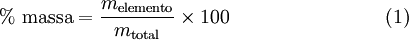
Recorrendo à análise elementar, é possível determinar a percentagem mássica de cada elemento existente num determinado composto. Veja-se o seguinte exemplo do estabelecimento da fórmula empírica do ácido ascórbico (vitamina C) a partir da sua composição elementar:
| 40,92% |
Carbono (C)
|
| 4,58% |
Hidrogénio (H)
|
| 54,50% |
Oxigénio (O)
|
Após se ter determinado a composição da amostra, o passo seguinte é calcular para cada elemento a quantidade química relativa a partir da fração mássica (ou da percentagem em massa) e da massa molar respetiva. A conversão pode ser facilmente feita considerando supondo que se tem uma massa total de 100 g de composto:
\(n_\text{Carbono}=\frac{40,92 \text{ g}}{12,01 \text{ g} \cdot \text{mol}^{-1}}=3,407 \text{ mol / 100g}\)
\(n_{\text{Hidrog }\!\!\acute{\mathrm{e}}\!\!\text{ nio}}=\frac{4,58 \text{ g}}{1,008 \text{ g} \cdot \text{mol}^{-1}}=4,54 \text{ mol / 100g}\)
\(n_{\text{Oxig }\!\!\acute{\mathrm{e}}\!\!\text{ nio}}=\frac{54,50 \text{ g}}{15,99 \text{ g} \cdot \text{mol}^{-1}}=3,406 \text{ mol / 100g}\)
Verifica-se que os elementos C:H:O estão numa proporção 3,407: 4,54: 3,406. Assim, poderia representar-se o composto pela fórmula C3,407H4,54O3,406. No entanto, a fórmula empírica representa as proporções molares em que os elementos se encontram num composto utilizando os menores números inteiros. Um processo expedito de obter estes números (sem calcular o seu máximo divisor comum) consiste em dividir a quantidade relativa de cada elemento pelo menor número encontrado (neste caso, 3,406) obtendo-se uma proporção molar 1,00:1,33:1,00.
Como um dos números ainda não é inteiro, é necessário multiplicar os números obtidos por um factor até obter valores inteiros para todos os números da fórmula. Neste caso multiplicando por 3 obtém-se a proporção molar (e também atómica) 3:4:3 para os elementos C:H:O. Assim, o ácido ascórbico (vitamina C) apresenta a fórmula empírica C3H4O3 , ou seja, por cada 3 átomos de carbono existem 4 átomos de hidrogénio e 3 átomos de oxigénio.
Este artigo já foi visualizado 5064 vezes.



