Laboratório com cinco sentidos
📧 , 📧
- * CITAB, DeBA, UTAD
- ɫ CITAB, DeBA, UTAD
Referência Anjos, R., Pinto, T.M., (2016) Laboratório com cinco sentidos, Rev. Ciência Elem., V4(2):021
DOI http://doi.org/10.24927/rce2016.021
Palavras-chave Laboratório; sentidos; biologia; teste; estoma;
Resumo
Numa sala de aula que se pretende cada vez mais participada e voltada para os estudantes, há que tornar os assuntos a debater mais atrativos e onde a componente teórica e prática surjam associadas. As matérias relacionadas com a morfologia das plantas assim como a bioquímica dos seus metabolismos, nem sempre aparecem interligadas, pelo que os estudantes mostram alguma dificuldade em as relacionar. Pretendeu-se com a dinamização do workshop “Laboratório com cinco sentidos”, relacionar estas duas componentes da Biologia, com a apresentação de trabalhos práticos de fácil execução e pouco exigentes em termos de reagentes e equipamentos. Desta forma, a implementação dos protocolos sugeridos em contexto de sala de aula, permitirá uma aquisição de informação, por parte dos estudantes, atrativa e participada onde a procura peloconhecimento será uma constante.
Açúcares às cores — estudo laboratorial dos
glúcidos
Os glúcidos podem ser identificados por reações
colorimétricas com reagentes específicos. Esses testes podem ser
utilizados para determinar o tipo de glúcido existente numa solução
(análise qualitativa).
A. Testes baseados na produção de furfural
ou derivados de furfural
Quando um monossacárido é
tratado com uma solução concentrada de ácido, verifica-se a desidratação
do monossacárido.
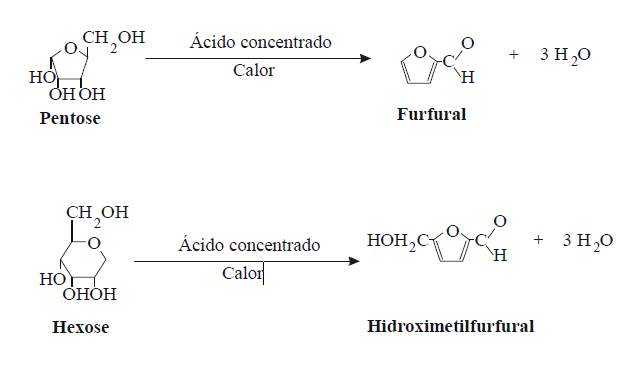
Se no meio ácido onde ocorreu a formação de furfural ou hidroximetilfurfural se encontrarem naftol, resorcinol ou orcinol (compostos fenólicos), formar-se-ão produtos de condensação corados.
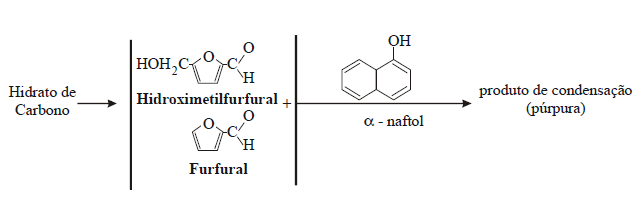
Teste de Molisch
Os monossacáridos
desidratados em furfural e/ou hidroximetilfurfural combinam-se com o
α-naftol, formando um complexo de cor púrpura.
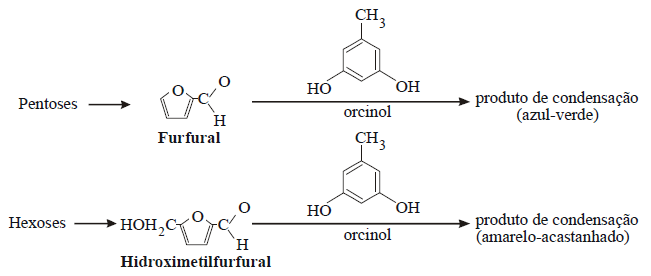
Teste de Bial
As pentoses
previamente desidratadas condensam com orcinol, em presença de iões
férricos, para dar produtos de cor azul-esverdeada enquanto nas mesmas
condições, as hexoses reagem com o orcinol produzindo um complexo
amarelo-acastanhado.
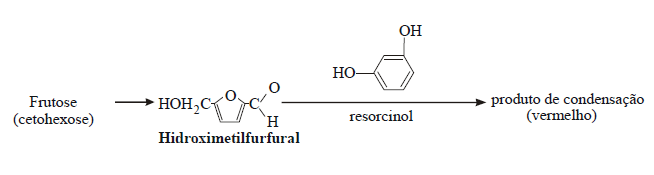
Teste de Seliwanoff
Neste teste as cetohexoses reagem com o resorcinol para
dar um produto de condensação de cor vermelha clara enquanto as aldohexoses originam produtos rosa pálido.
B. Testes baseados nas propriedades
redutoras dos açúcares
Glúcidos com grupos aldeído ou
cetona livres podem reduzir agentes oxidantes fracos, tais como iões
Cu2+, CN- e Ag+. A cor do precipitado
poderá variar de verde a castanho avermelhado, dependendo da
concentração do açúcar redutor presente.
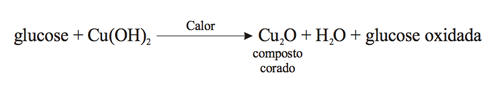
Teste de Benedict
Os monossacáridos
e dissacáridos que possuem um grupo aldeído livre ou potencialmente
livre são oxidados por certos agentes oxidantes, tais como iões Cu2+,
que, sendo reduzidos a Cu+, precipitam na forma de
CuO2 (que apresenta cor vermelha). O reagente de Benedict é
uma solução alcalina de sulfato de cobre, carbonato de sódio e citrato
de sódio. O citrato de sódio existente no reagente forma um complexo
solúvel com os iões Cu2+, evitando a sua precipitação sob a
forma de Cu(OH)2 (de cor azul) ou de CuO (de cor preta). Os
açúcares redutores, mono- e dissacáridos, dão em geral testes de
Benedict positivos.
Teste de Barfoed
O reagente de
Barfoed, que contém acetato de cobre em ácido acético diluído, é
utilizado para distinguir os monossacáridos redutores dos dissacáridos
redutores. Este teste difere do teste de Benedict no facto da reação de
oxidação-redução ser realizada em meio acídico (pH 4,5), em vez de
alcalino. A este pH, os dissacáridos não reduzem os iões Cu2+
a CuO2, enquanto os monossacáridos reduzem os iões
Cu2+, quando aquecidos durante 2 minutos num banho de água
fervente. De referir, também, que o óxido cuproso, neste teste,
apresenta cor de tijolo, enquanto no teste de Benedict é
laranja-acastanhado, devido ao pH ácido do reagente de Barfoed.
C. Teste de iodo
Os
polissacáridos apresentam uma cor característica, quando tratados com
uma solução de iodo, na forma de KI. O amido pode ser especificamente
detetado, em virtude da sua habilidade de formar um complexo azul-escuro
com o iodo. Esse complexo consiste numa disposição linear de aglomerados
de átomos de iodo (iões pentaiodeto, I5-) entre as cavidades helicoidais
da amilose. A amilose existe na forma de uma cadeia helicoidal, contendo
seis resíduos glicosídicos por volta. É requerido um comprimento de
cadeia mínimo de seis voltas da hélice (36 grupos glicosídicos) para se
formar o complexo com o iodo. Polissacáridos ramificados, com hélices
interrompidas (p.e. amilopectina) formam complexos corados menos
intensos, enquanto polissacáridos fortemente ramificados (p.e.
glicogénio), com pequenos segmentos helicoidais e impedidos de formar
hélices maiores, originam complexos corados de uma cor
castanho-avermelhada pálida. O iodo forma, assim, complexos corados com
os polissacáridos, produzindo uma cor azul na presença do amido,
enquanto na presença de glicogénio e de amido parcialmente hidrolisado a
cor que se desenvolve é vermelho-acastanhada.
As impressões digitais dos estomas
Introdução
Uma planta vascular
começa a sua existência num ovo unicelular. O ovo transforma-se em
embrião e este em planta adulta.
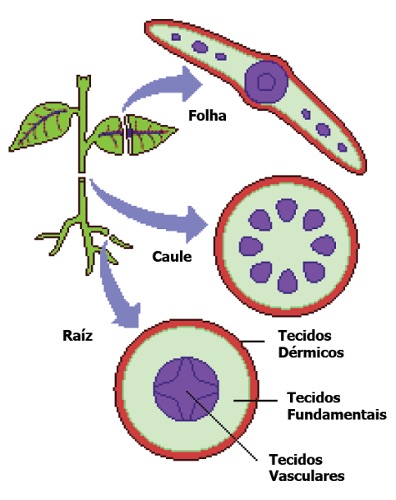
Numa planta superior com sementes, distinguem-se bem as folhas, o caule e a raiz, órgãos de morfologia e funções bem determinadas. Os órgãos das plantas são constituídos por tecidos e estes por um ou mais tipos de células. Como pode ser observado na Figura 1, a disposição das células e dos tecidos não é casual, revela sim uma organização estrutural e funcional bem definida (Esau, 1998).
Objetivos
Pretende-se com este
trabalho apresentar uma técnica histológica simples, de fácil
reprodução, que permite a identificação e caracterização de estomas.
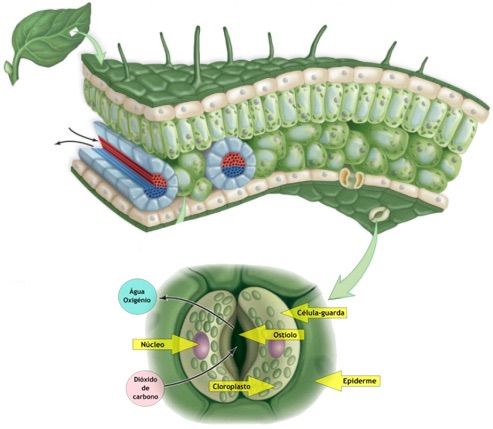
Estomas
São aberturas na epiderme,
através das quais o caule e folhas estabelecem trocas gasosas com o meio
ambiente, ou seja, entrada de CO2 e O2 e saída de
vapor de água (Figura 2).
Podemos observá-los?
Sim.
É difícil?
Não.
Preciso de material caro?
Não,
é só seguir um protocolo simples como o mostrado aqui.
Referências
- 1 Bacelar, E.; Correia, C.M.; Moutinho-Pereira, J.; Gonçalves, B.; Lopes, J.I.; Torres-Pereira, J.M.G, 2004. Sclerophylly and leaf anatomical traits of five field-grown olive cultivars growing under drought conditions. Tree Physiology 24, 233–239
- 2 CienTIC, 2016. Trocas gasosas nas plantas. Acedido em 15 de setembro de 2016
- 3 http://www.cientic.com/portal/index.php?option=com_content&view=article&id=209:autotro%20fia-parte-i&c
- 4 Esau, K., 1998. Anatomia das Plantas com Sementes. 14ª Edição, Edgard Blucher, São Paulo
- 5 Meyer, B.S.; Anderson, D.B.; Bohning, R.H.; Fratianne, D.G., 1983. Introdução à Fisiologia Vegetal. 2ª Ed., Fundação Calouste Gulbenkian, Lisboa, 710p
- 6 Webb, D.T., 1997. Primary vs Secondary Growth – 5. Acedido em 12 de fevereiro 1997
Este artigo já foi visualizado 14071 vezes.



