Espectroscopia
📧
- Universidade de Aveiro
Referência Claro, P.R., (2017) Espectroscopia, Rev. Ciência Elem., V5(4):052
DOI http://doi.org/10.24927/rce2017.052
Palavras-chave Espectroscopia;
Resumo
A espectroscopia é uma técnica experimental que se baseia na utilização da luz para estudar a composição, a estrutura e as propriedades da matéria. A raiz da palavra, do latim spectrum (imagem, aparição), remete para algo como “observação da imagem oculta”. Embora historicamente tenha origem na observação da luz visível dispersa por um prisma, o conceito atual abarca qualquer descrição da interação radiação-matéria em função da energia da radiação.
Numa experiência de espectroscopia, a amostra a estudar é irradiada com o feixe de luz incidente e a análise é feita à luz transmitida, emitida ou difundida pela amostra (FIGURA 1). O resultado obtido é um registo que compara a composição da luz incidente na amostra com a luz transmitida, emitida ou difundida, e é designado por “espectro” da amostra. O registo de um espectro é efetuado através de equipamentos experimentais designados por espectrómetro, espectrofotómetro e espectrógrafo.
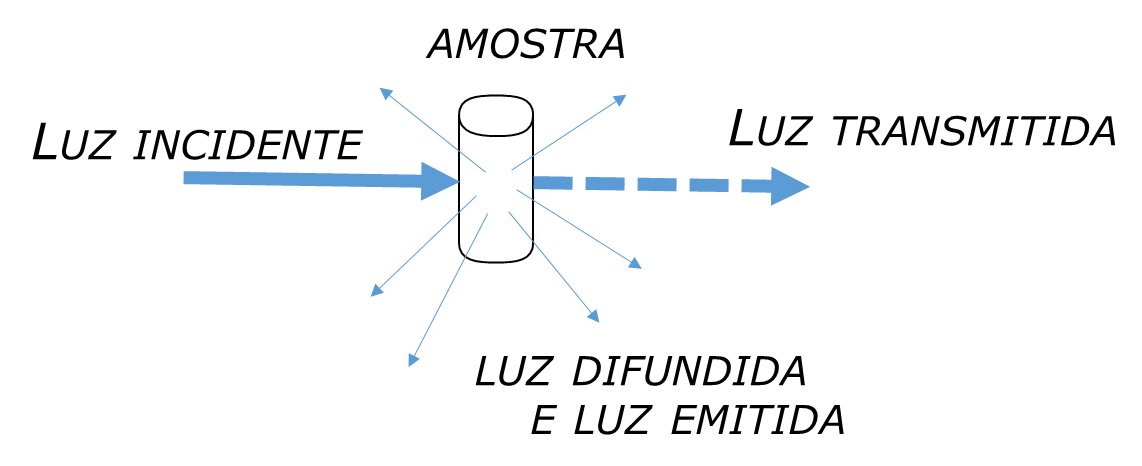
Para entender o fenómeno de interação radiação-matéria que está na base da espectroscopia, são necessários dois conceitos, relacionados com as propriedades da luz e com a natureza quântica da matéria:
- A luz, ou radiação eletromagnética, tem energia diferente consoante a sua frequência (ou consoante o seu comprimento de onda, que varia inversamente à frequência). Por exemplo, na região do visível, a energia da radiação aumenta ao longo das cores do arco-íris, do vermelho até ao violeta. A radiação infravermelha tem menor energia que o vermelho, e a luz ultravioleta tem energia superior ao violeta (energia suficiente para danificar a pele, daí a necessidade de protetores solares para ultravioleta).
- Os sistemas atómico-moleculares que constituem a matéria apresentam estados de energia discretos, que podem ser vistos como os degraus de uma escada: cada degrau é um nível de energia e é possível subir/descer de nível recebendo/libertando a energia correspondente à altura do degrau, mas não é possível estar a meio caminho, entre degraus. Se os níveis de energia fossem contínuos, a analogia seria com uma rampa, na qual é possível parar em qualquer local. Dependendo da natureza e composição da amostra, os “degraus” apresentam diferentes alturas, ou seja, sistemas atómico-moleculares diferentes apresentam níveis de energia com separações diferentes. E conhecer a separação entre os níveis de energia permite compreender a estrutura e as propriedades de uma dada amostra.
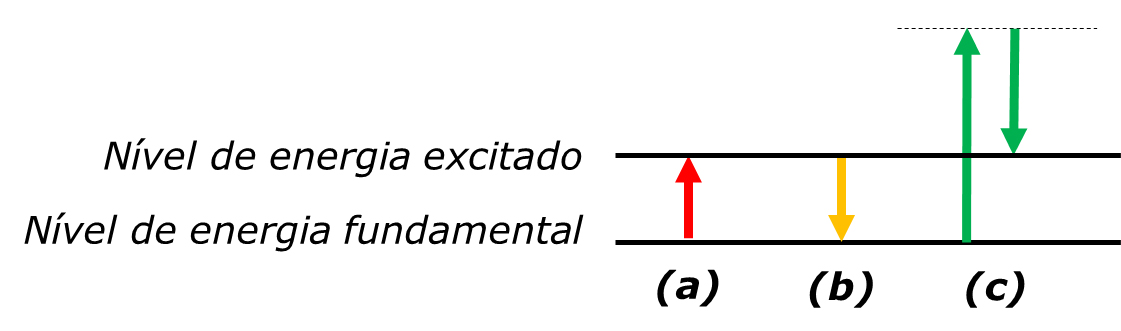
Assim, a espectroscopia utiliza a luz para medir a diferença de energia entre os níveis energéticos de um sistema. Isto pode ser feito de três formas (FIGURA 2): por absorção de radiação com a energia exata entre níveis (a), por emissão de radiação com essa mesma energia (b), ou por difusão inelástica (c) – neste caso, a diferença entre níveis é medida pela diferença de energia entre a luz incidente e a luz difundida.
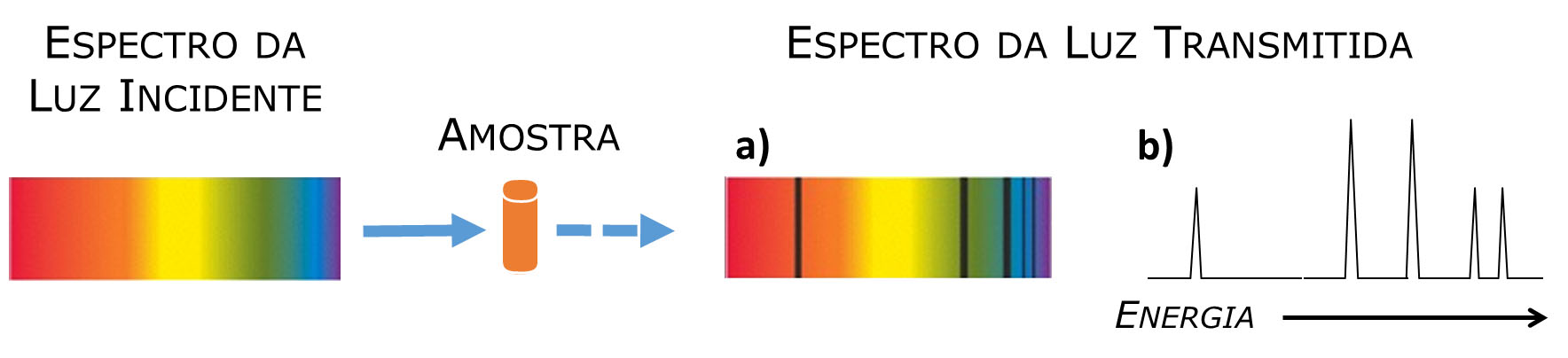
A FIGURA 3 ilustra esquematicamente um espectro de absorção, na sua representação original e na representação gráfica mais comum.
A abordagem mais rigorosa da interação radiação-matéria exige o aprofundamento dos dois conceitos fundamentais acima referidos. Relativamente à composição e propriedades da luz, esta pode ser descrita pelas propriedades de radiação eletromagnética (oscilação de um campo elétrico e de um campo magnético, com determinada frequência e comprimento de onda) ou pelo comportamento de partícula de energia, designada por fotão. Também no que respeita aos níveis de energia de um sistema atómico-molecular, é necessário saber que estão associados a rotações moleculares, a vibração dos átomos em torno das posições de equilíbrio e à distribuição dos eletrões pelas orbitais moleculares. Cada nível é descrito por uma função de onda, e a intensidade da interação radiação-matéria é proporcional ao integral que relaciona as funções de onda do estado inicial e final com o operador de transição.
Tipos de Espectroscopia
Os diferentes métodos de registar a interação radiação-matéria são classificados como sub-técnicas da espectroscopia de acordo a natureza da interação (FIGURA 2), o tipo da transição observada (rotacional, vibracional ou eletrónica) e a energia da radiação utilizada.
A espectroscopia rotacional é uma espectroscopia de absorção de radiação, que observa transições entre níveis rotacionais de moléculas em estado gasoso. A separação energética entre estes níveis é muito pequena, pelo que a radiação utilizada é de baixa energia, na região das micro-ondas. Por este motivo, utiliza-se a designação espectroscopia de micro-ondas como sinónimo.
A espectroscopia vibracional observa transições entre níveis vibracionais de qualquer tipo de associação de átomos: desde que exista uma energia de coesão entre átomos, eles vibram em torno das suas posições de equilíbrio. A energia associada a estas transições cai na região do infravermelho, motivo porque é também designada espectroscopia de absorção no infravermelho, ou simplesmente espectroscopia de infravermelho.
A espectroscopia eletrónica regista as diferenças de energia que acompanham as transições eletrónicas, utilizando radiação de energia mais elevada, da região do visível e ultravioleta (UV). Quando se regista em modo de absorção, é também designada por espectroscopia de UV-Vis. No caso da espectroscopia eletrónica, é também comum registar a radiação emitida quando os eletrões transitam de níveis de maior energia para níveis de menor energia. Nessa situação, poderemos observar a espectroscopia de emissão, a espectroscopia de fluorescência ou luminescência.
Alguns tipos de espectroscopia afastam-se bastante desta descrição simplificada.
Por exemplo, espectroscopia de difusão de Raman – que deve a sua designação ao cientista indiano C. V. Raman (1888-1970) – é uma técnica de espectroscopia vibracional que não se baseia na absorção, mas sim no fenómeno de difusão inelástica da luz. O termo inelástico indica que a energia do fotão difundido é diferente da energia diferente do fotão incidente (obviamente, existe a difusão elástica, sem alteração da energia do fotão incidente).
O espectro vibracional pode também ser obtido através da espectroscopia de difusão inelástica de neutrões, que utiliza as propriedades ondulatórias de um feixe de neutrões de elevada energia, em vez de um feixe de luz. Por esse motivo não é considerada uma técnica de espectroscopia ótica. Também neste caso, a diferença de energia entre os níveis vibracionais é medida pela diferença de energia entre o neutrão incidente e o neutrão difundido.
Fora das chamadas espectroscopias óticas fica também a espectroscopia de ressonância magnética nuclear (RMN). Neste caso, os níveis de energia a observar (relacionados com uma propriedade dos núcleos atómicos designada spin nuclear) são desdobrados por aplicação de um campo magnético. Na ausência do campo magnético, os níveis têm a mesma energia, ou seja, separação nula. A separação energética provocada pelo campo magnético pode ser observada com radiação de radiofrequências, de muito baixa energia.
Este artigo já foi visualizado 8237 vezes.



