Notícias
Referência (2019) Notícias, Rev. Ciência Elem., V7(1):013
DOI http://doi.org/10.24927/rce2019.013
Palavras-chave Notícias;
Em busca de Elementos Superpesados
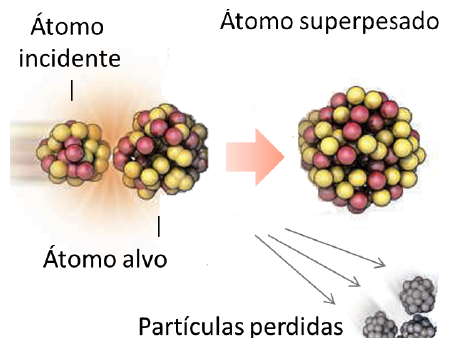
O elemento mais pesado encontrado numa quantidade apreciável na natureza é urânio, número atómico 92 (o número atómico refere-se ao número de prótões no núcleo de um átomo). Mas os cientistas já estenderam a tabela periódica até ao número atómico 118 (Oganésson, símbolo Og, cuja síntese foi confirmada em 2015 pela IUPAC e IUPAP).
Agora, no célebre laboratório russo Laboratório Flerov de Reações Nucleares, cujos aceleradores produziram nove novos elementos no último meio século, os cientistas preparam-se para expandir a tabela periódica mais uma vez. Uma instalação de mais de 50 milhões de euros começará a procurar o elemento 119, 120 ou ambos, nesta primavera. Os novos elementos estenderiam a Tabela Periódica – agora com sete períodos completos – até ao oitavo período, para o qual algumas teorias preveem o surgimento de propriedades exóticas. Os elementos nesse período podem até mesmo destruir a própria periodicidade da tabela, porque as propriedades físicas e químicas podem deixar de se repetir em intervalos regulares. Empurrar ainda mais o oitavo período pode também responder a questões com as quais os cientistas lutam desde os tempos de Dmitri Mendeleiev: Quantos elementos existem? E até onde vai a Tabela Periódica?
Hélio: no topo da Tabela e nas profundezas da Terra
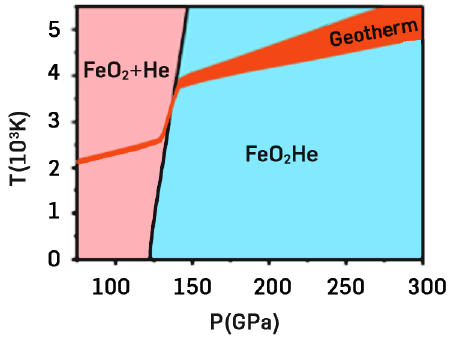
O primeiro composto dos gases nobres, XePtF6, foi reportado pela primeira vez por Neil Bartlett em 1962. Seguiram-se outros, mas só nos últimos anos o mais leve dos gases nobres, o hélio, começou a perder sua reputação de “gás efetivamente inerte”. A altas temperatura e pressão, parece capaz de formar ligações relativamente fracas com outros átomos e moléculas. Os átomos de hélio, como outras espécies hidrofóbicas, pode ocupar cavidades em clataratos de água, mas aí forma interações de van der Waals e não ligações químicas genuínas. No entanto, a pressões elevadas, da ordem dos 300 GPa, as moléculas de água parecem capazes de formar ligações com os átomos de hélio, com energia comparável à das ligações de hidrogénio. Acima dos 4 TPa espera-se que o hélio possa formar compostos com ferro. Os átomos de hélio apresentam apenas um pequeno grau de partilha de eletrões dos átomos de ferro, mas estabilizam o composto através de blindagem eletrostática.
Estes compostos de ferro podem ser a solução de um quebra-cabeças geoquímico: se é verdade que existe dentro da Terra profunda um reservatório de hélio primordial, onde se encontrará? A partir de cálculos de primeiros princípios, foi identificada uma forma cúbica de FeO2He, um óxido de ferro contendo hélio, estável nas condições de pressão e temperatura comparáveis às do limite núcleo-manto – que os autores apresentam como candidato para reservatório de hélio (DOI: 10.1103/PhysRevLett.121.255703). Depois de décadas a ser vista como uma curiosidade, a química deste gás nobre está agora a provar ser de considerável relevância para a composição dos interiores planetários.
Química Supramolecular no íntimo da Tabela Periódica
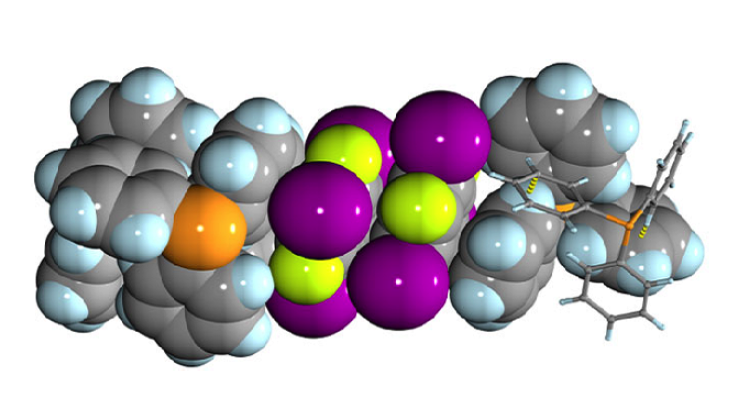
Grande parte da investigação recente em química concentrou-se na criação de novos materiais, manipulando a forma como as moléculas se reconhecem e se unem para construir estruturas mais complexas e auto-organizadas. Por exemplo, os cocristais baseados em pontes de hidrogénio ou de halogénio têm sido amplamente utilizados pelos cientistas na conceção e produção de novos produtos farmacêuticos aperfeiçoados, polímeros com propriedades aprimoradas, como Kevlar e materiais para uso em eletrónica. Até recentemente, estas interações tinham que incluir invariavelmente pelo menos um átomo de um elemento ‘mais leve’, encontrado no topo da tabela periódica, como hidrogénio, nitrogénio, oxigénio, flúor, etc.
Mas uma publicação recente na Nature Communications (DOI 10.1038/s41467-018-07957-6) fornece a primeira prova experimental e teórica de que é possível formar atrações fortes e estáveis entre alguns dos elementos mais pesados da tabela periódica - como o arsénio (número atómico 33) ou mesmo o antimónio (número atómico 51). Segundo Tomislav Friščić, um dos principais autores do artigo, “além das potenciais aplicações práticas desta descoberta, é um grande avanço na química fundamental. Pela primeira vez, os cientistas demonstraram eventos de reconhecimento molecular baseados apenas em elementos ‘mais pesados’, localizados nos períodos 4 e 5. Isso é significativamente mais para o fundo da Tabela Periódica do que reportado até agora. É um momento muito emocionante para ser um químico - é como se fôssemos exploradores a aproximarmo-nos do Polo Sul da Tabela Periódica - e quem sabe o que encontraremos lá.”
Este artigo já foi visualizado 3726 vezes.



