MHETase
Uma Enzima Fundamental para a Biodegradação do Plástico
📧 , 📧 , 📧
- * Universidade do Porto
- ɫ Universidade do Porto
- ‡ Universidade do Porto
Referência Ferreira, C., Fernandes, P. A., Ramos, M. J., (2021) MHETase, Rev. Ciência Elem., V9(4):069
DOI http://doi.org/10.24927/rce2021.069
Palavras-chave Ambiente, bioquímica, plásticos, PET, polietileno de tereftalato, bactéria, catalítica, Ideionella sakaiensis, enzimas, hidrólase, PETase, MHETase, biodegradação
Resumo
A poluição provocada pelo uso exagerado de plástico, mais concretamente do PET (polietileno de tereftalato), é um dos problemas ambientais mais importantes nos dias de hoje, afetando o mundo inteiro. Vários estudos foram realizados para contornar este problema, tendo sido obtidos resultados inovadores através do isolamento de uma bactéria denominada Ideionella sakaiensis que, na presença de PET, secreta duas enzimas hidrolases, a PETase e a MHETase, que revertem o PET aos monómeros a partir dos quais ele foi fabricado. Estas duas enzimas revelaram-se extraordinariamente importantes para a biodegradação do PET. Neste artigo analisa-se a estrutura de uma delas — a MHETase.
Os plásticos, devido às suas extraordinárias características como leveza, preço baixo, fácil e rápida produção, impermeabilidade, maleabilidade e transparência, tornaram-se uma parte integral da vida do ser humano e têm sido usados de uma forma crescente, em inúmeras áreas, tais como o fabrico de embalagens e na indústria têxtil. Contudo, os plásticos têm uma elevada resistência à degradação devido à ausência ou baixa atividade das enzimas catabólicas dos microorganismos que os poderiam degradar1 e, por isso, permanecem durante quatro-cinco séculos nos diversos ecossistemas — se o autor da grande obra Lusíadas, Luís de Camões, tivesse lançado uma garrafa de PET ao mar, ela ainda estaria presente a flutuar nos dias de hoje! Desta forma, cria-se assim o problema da poluição dos plásticos. Neste trabalho, considera-se um plástico sintético particular, o PET (polietileno de tereftalato), um dos termoplásticos mais utilizados, devido às suas extraordinárias características mecânicas, térmicas, elétricas e químicas. Este plástico é sintetizado pela policondensação de ácido tereftálico (TPA) e etilenoglicol (EG), ambos derivados do petróleo bruto. Esta reação tem lugar conforme evidenciado na FIGURA 1. É de notar que “n”, nessa reação indica a presença de um polímero, ou seja são necessários n monómeros para obtenção do polímero PET.
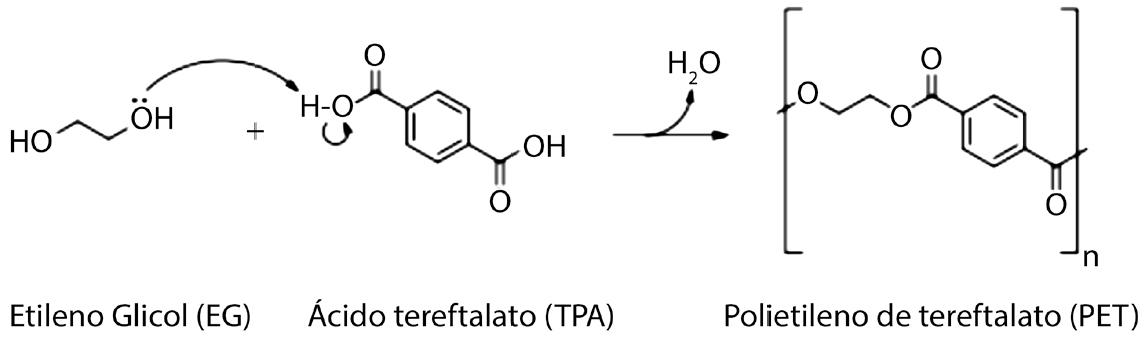
Obtém-se assim um polímero que cristaliza, devido à sua estabilidade química e estrutural, podendo encontrar-se num estado amorfo ou cristalino. As garrafas constituídas por este tipo de plástico possuem alta cristalinidade, o que traduz uma dificuldade acrescida das enzimas para o biodegradar, pois o material apresenta cadeias poliméricas mais paralelas e compactamente organizadas2.
A biodegradação do PET é uma potencial estratégia para contornar o problema da poluição causada pelo PET. Foram já obtidos resultados inovadores usando técnicas de biodegradação com bactérias que usam o PET como a sua principal fonte de carbono, que posteriormente, será usada para o seu crescimento1.
Esta metodologia baseia-se na capacidade catalítica de bactérias particulares para clivar as ligações do polímero em estudo3, mais concretamente, as ligações tipo éster, presentes no PET, usando hidrólise enzimática, aquando ocupação da superfície do material em questão. As bactérias têm, na sua constituição, várias enzimas (catalisadores biológicos) que servem para sintetizar e para degradar, de forma rápida, os compostos químicos necessários ao seu funcionamento4. Na bactéria Ideonella Sakaiensis em específico, quando cultivada em PET, detetam-se duas enzimas, a PETase e MHETase, ambas do tipo protease serina, que demonstram atividade na degradação do PET. A PETase apresenta um domínio α/β — hidrolase, e converte PET em MHET (mono-2-hidroxetil tereftalato)4. Por outro lado, a MHETase apresenta um domínio como a PETase, ou seja, apresenta um domínio α/β — hidrolase, típico de uma protease serina, mas também apresenta um domínio tampa.

A MHETase ainda hidrolisa subsequentemente o MHET, produto fundamental da hidrólise do PET pela PETase, em ácido tereftálico (TPA) e etileno glicol (EG)6, que são os monómeros a partir dos quais o plástico PET se produz. Posteriormente, estes monómeros, pelo processo contrário ao da degradação enzimática, poderão conseguir originar novamente PET, reciclando o material usado (FIGURA 2).
A PETase e a MHETase participam na catálise de reações idênticas, mas em regiões distintas. O conhecimento atual sugere um mecanismo em que a PETase, extracelular, hidrolisa o PET, sendo MHET o principal produto. Este é posteriormente transportado, através de uma proteína de membrana (por exemplo uma porina), até ao espaço periplasmático da bactéria em estudo, I.sakaiensis, onde a MHETase, presente na membrana externa o hidrolisa, convertendo-o nos produtos já mencionados, ou seja, acido tereftálico e etileno glicol. Por último, estes produtos são levados para o citoplasma, onde são metabolizados3.
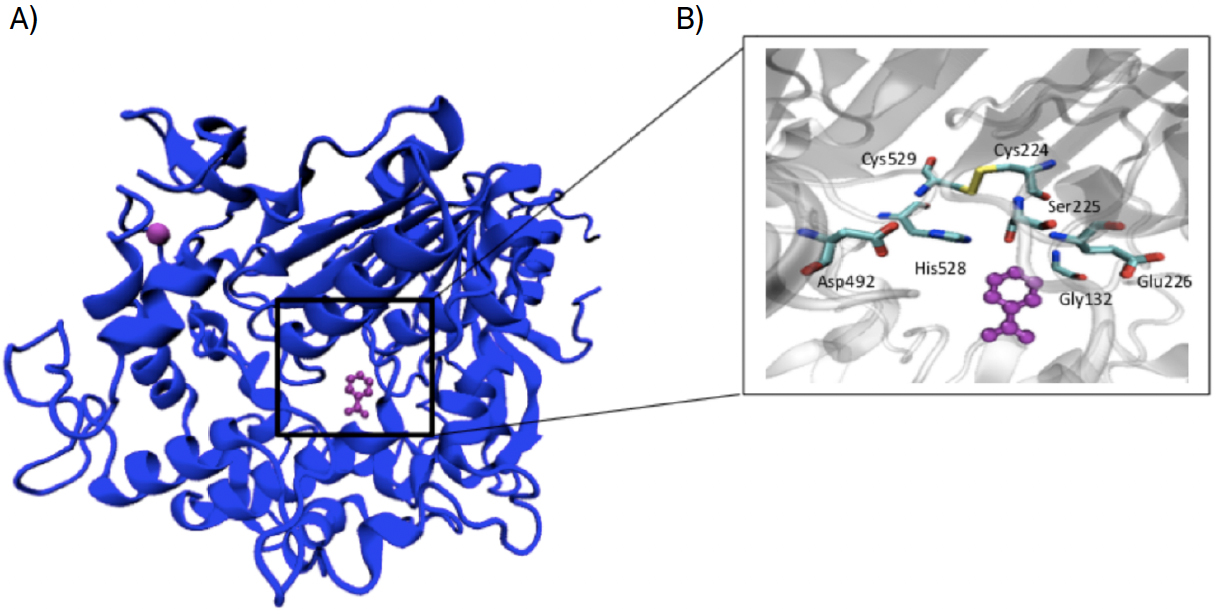
Através da FIGURA 3A) consegue-se observar que a MHETase representada a azul escuro, é um monómero. A roxo é possível visualizar o ião Ca2+ no canto superior esquerdo e o ligando benzoato (BEZ), um composto análogo ao substrato, representado no centro. Na FIGURA 3B) é possível observar o centro ativo da enzima com o ligando benzoato, colorido a roxo; a tríade catalítica, constituída pelos resíduos Ser225, His528 e Asp492, e a ligação dissulfureto que faz parte do centro ativo, e constituída pelos resíduos Cys224 e Cys529.
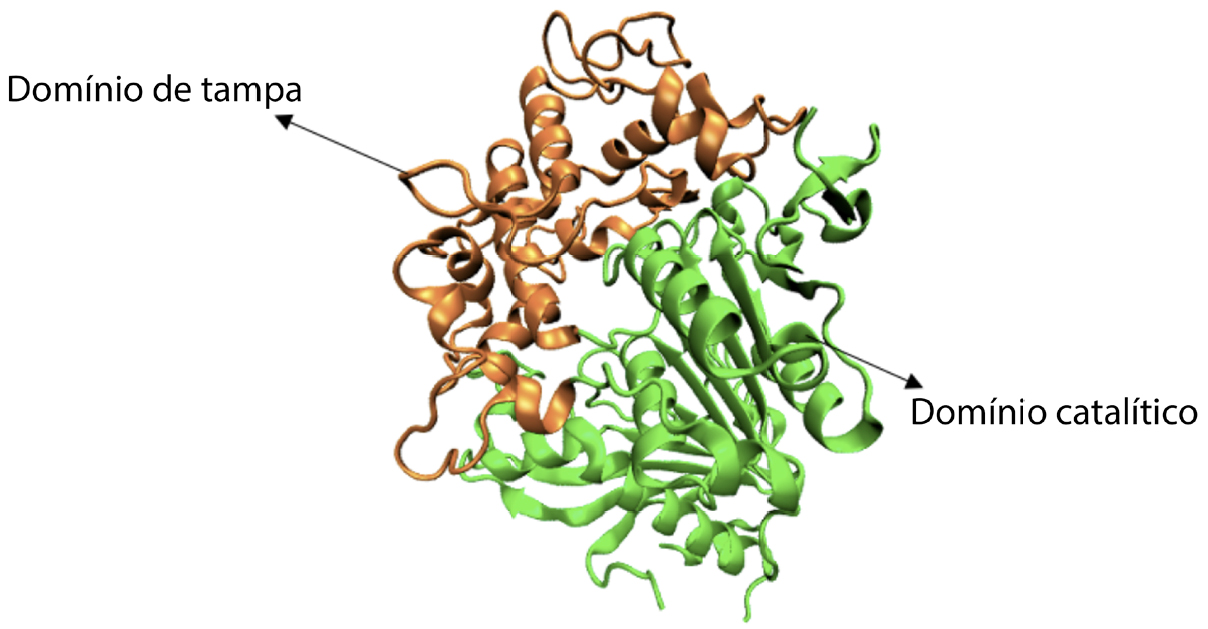
Esta enzima é constituída por dois domínios, um domínio catalítico que adota o enrolamento de uma α/β — hidrolase típica das hidrolases serina e um extenso domínio tampa. Este domínio é constituído por 7 folhas beta e por 15 hélices alfa. No caso do domínio de tampa, este é constituído pelos resíduos 254 - 468, de um total de 603 resíduos que estão presentes na estrutura completa da MHETase. Este domínio encontra-se representado a laranja na FIGURA 4. O domínio catalítico está representado a verde na FIGURA 4.
Ao contrário da PETase, estudos indicam que a MHETase se liga melhor e mais fortemente ao substrato, devido à presença do domínio de tampa. Um dos resíduos importantes para este aspeto é a Phe415, que tem um papel fundamental na entrada do substrato. Na estrutura da MHETase sem o ligando MHET, o resíduo Phe415 aponta para fora do centro ativo, permitindo assim a entrada do substrato. A associação com o ligando MHET vai provocar uma rotação de 180o da cadeia lateral daquele resíduo de aminoácido, fechando assim o centro ativo e consolidando a interação6.
A poluição provocada pelo plástico é uma ameaça para o ser humano e para a sustentabilidade do planeta e, por isso, é urgente arranjar uma solução eficaz e ecologicamente correta para tratar este problema. Já existem alguns métodos de degradação de plástico, por exemplo, reciclagem química e física. Contudo, estes têm consumos energéticos elevados, necessitam de temperaturas muito elevadas, produzindo consequentemente quantidades enormes de dióxidos de carbono. Além disso, são processos dispendiosos, o que não é de todo uma opção viável e sustentável do ponto de vista económico a longo prazo7. A solução aqui apresentada parece ser uma ótima opção na medida em que se consegue, para além de degradar o PET nos seus monómeros, produzi-lo forma sustentável. A estrutura da MHETase tem um papel fundamental na compreensão do mecanismo de degradação do PET. No entanto, é ainda necessário realizar muito trabalho sobre esta alternativa, de forma a provar e tornar este mecanismo de duas enzimas uma alternativa viável para processos de larga escala.
Referências
- 1 YOSHIDA, S. et al., A bacterium that degrades and assimilates poly(ethylene terephthalate), Science, 351, 6278, p. 1196-9. 2016.
- 2 DEMIREL, B.Y. & ALI, E., Crystallization Behavior of PET Materials. 2011.
- 3 CARR, C. M. et al., Microbial Polyethylene Terephthalate Hydrolases: Current and Future Perspectives, Front Microbiol, 11, p. 571265. 2020.
- 4 KIM, J. W. et al., Functional expression of polyethylene terephthalate-degrading enzyme (PETase) in green microalgae, Microb Cell Fact, 19, 1, p. 97. 2020.
- 5 BERSELLI, A. et al., Novel Pet-Degrading Enzymes: Structure-Function from a Computational Perspective, Chembiochem. 2021.
- 6 PALM, G. J. et al., Structure of the plastic-degrading Ideonella sakaiensis MHETase bound to a substrate, Nat Commun, 10, 1, p. 1717. 2019.
- 7 HIRAGA, K. et al., Biodegradation of waste PET: A sustainable solution for dealing with plastic pollution, EMBO Rep, 20, 11, p. 49365. 2019.
Este artigo já foi visualizado 7810 vezes.



