Os gâmetas
no contexto da reprodução humana assistida
📧 , 📧
- * CIIMAR/ Universidade do Porto
- ɫ DB/ FCUP
Referência Aleixo, A. M., Almeida, V., (2022) Os gâmetas, Rev. Ciência Elem., V10(1):009
DOI http://doi.org/10.24927/rce2022.009
Palavras-chave Ética, Reprodução Medicamente Assistida, doença do sistema reprodutivo, taxa de fecundidade, endometriose, qualidade seminal, espermograma, gâmetas, peso excessivo, obesidade
Resumo
Estima-se que, em todo o mundo, entre 10% a 15% dos casais em idade fértil não consigam realizar o sonho de gerar um filho1. Diz-se, neste caso, que o casal enfrenta problemas de infertilidade, sendo esta condição uma causa considerável de sofrimento emocional e psicológico2. No passado, a infertilidade era considerada como uma fatalidade biológica insuperável mas, atualmente, os casais inférteis têm na reprodução humana assistida a possibilidade de realizar o seu objetivo de alargamento da família3. A importância destas técnicas é revelada por estudos recentes, que mostram que 1 em cada 50 crianças que nascem na Europa são resultado de tratamentos de reprodução humana assistida4.
Um dos primeiros passos para avaliação da situação de infertilidade e escolha do caminho a seguir (entre as diversas técnicas disponíveis), passa pela avaliação dos gâmetas do casal, ou seja, das suas células reprodutoras. Para a maior parte dos tratamentos de reprodução humana assistida será necessária a recolha desses gâmetas e a sua preservação, o que acarreta grandes desafios tecnológicos e éticos à comunidade científica.
Gâmetas masculinos
O espermograma é uma análise da amostra seminal que permite avaliar o potencial de fertilidade do homem. Faz-se um estudo das características de visualização direta e das características microscópicas do sémen. Assim, é possível obter informações importantíssimas: se a espermatogénese (processo de formação dos gâmetas masculinos, que ocorre no interior dos testículos) ocorre de forma expectável, se ocorre o amadurecimento dos espermatozoides, se os canais deferentes estão desimpedidos e se as glândulas anexas estão a funcionar de forma correta.
O exame macroscópico inclui parâmetros como aparência visual, liquefação, viscosidade, volume e pH. Paralelamente, deve ser realizado um exame microscópico que permita avaliar a motilidade, vitalidade, concentração e morfologia dos espermatozoides, bem como a presença de outras células não espermáticas (como células epiteliais, células germinativas imaturas ou leucócitos, por exemplo) ou de anticorpos anti-espermatozoides (FIGURA 1).
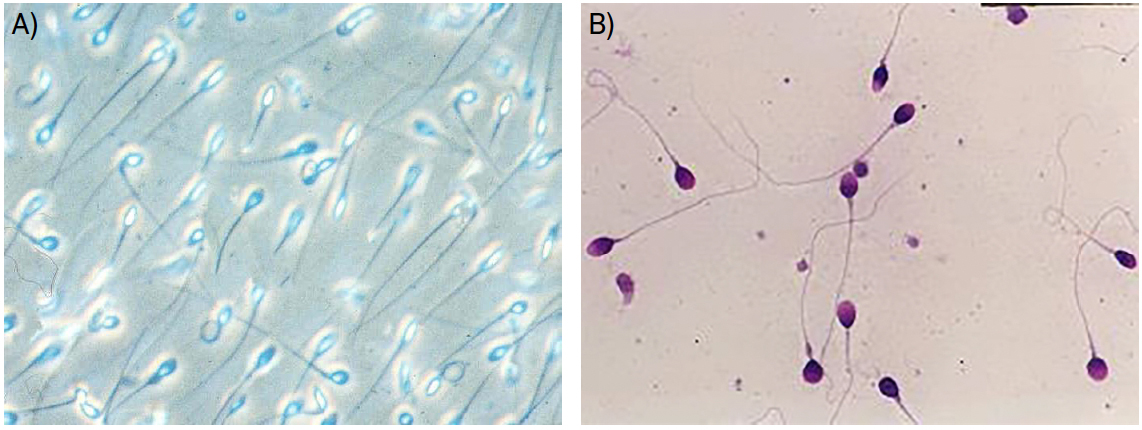
As medições obtidas devem ser comparadas com valores de referência, definidos pela Organização Mundial de Saúde (OMS), expressos na TABELA 11. Contudo, é importante salientar que poderá haver homens cujas características de amostra seminal estejam abaixo destes valores sem apresentarem quadros de infertilidade5.
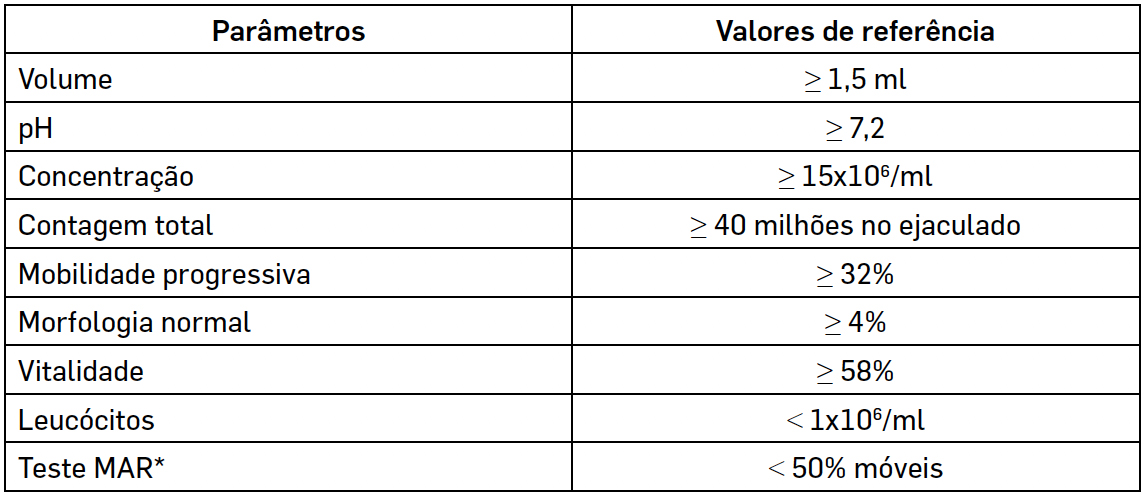
Embora estes sejam os valores de referência, estudos recentes mostram o quanto os avanços tecnológicos permitem melhorar as metodologias para análise da qualidade espermática, definindo melhor a infertilidade masculina e fornecendo melhores prognósticos para as técnicas de reprodução humana assistida que tenham de ser utilizadas6. Um exemplo é um estudo muito recente que alerta para a quantidade de espermatozoides com ADN fragmentado mas morfologia normal, encontrados em muitos indivíduos inférteis, contrariando a ideia generalizada de que gâmetas com aspeto padronizado teriam, inevitavelmente, conteúdo normal de ácidos nucleicos e, portanto, apresentavam garantia de serem viáveis7. Outro estudo salienta que o conhecimento de marcadores moleculares de diferentes funções espermáticas pode ser útil para determinar novas estratégias terapêuticas e de diagnóstico da infertilidade masculina. Estes investigadores sugerem que se deve procurar a presença de determinadas proteínas nas membranas superficiais do espermatozoide, já que estas podem desempenhar um papel durante o desenvolvimento embrionário e, portanto, ser sinal de melhor qualidade e viabilidade do embrião8.
Daqui se depreende que novas abordagens diagnósticas, apoiadas em avanços tecnológicos, permitirão, no futuro, otimizar os valores que hoje consideramos como padrão. Isto, por seu lado, vai permitir uma avaliação mais rigorosa dos espermatozoides e, consequentemente, contribuir para um sucesso maior das técnicas de reprodução humana assistida.
Gâmetas femininos
O estudo da qualidade dos ovócitos e da função ovárica começa com exames que permitam avaliar parâmetros como a temperatura basal, quantificação de hormonas específicas (FSH — homona foliculostimulante, LH — hormona luteinizante, estradiol, progesterona e prolactina) ou a visualização dos ovários através de ecotomografia pélvica com sonda vaginal. Desta forma, o médico procura confirmar a reserva folicular dos ovários, se ocorre ovulação ou se há lesões ováricas que comprometam a fertilidade da mulher.
Através da administração de hormonas, é possível estimular os ovários artificialmente, induzindo o amadurecimento de vários folículos no mesmo ciclo e promovendo a ovulação. Este é um procedimento de base que pode, por si só, solucionar problemas de anovulação (ausência de ovulação, que representa a principal causa de infertilidade de fator feminino9).
Esta estimulação ovárica é também um passo essencial nas técnicas de reprodução humana assistida, uma vez que possibilita o aumento do número de ovócitos colhidos e, portanto, do número de embriões que poderão vir a formar-se (permitindo a seleção dos melhores, para transferência posterior e/ou que poderão ser criopreservados). Assim, consegue aumentar-se a taxa de gravidez.
A estimulação ovárica pode ser realizada de várias formas (recorrendo a diferentes substâncias) e opta-se por uma das hipóteses dependendo do estado clínico e do objetivo que se pretende. Algumas dessas substâncias interferem com os normais mecanismos de feedback negativo do estrogénio ao nível do complexo hipotálamo-hipófise, ocupando os recetores de estrogénio ou provocando a diminuição da sua produção. Assim sendo, há libertação de maiores concentrações de GnRH (hormona libertadora de gonadotrofina) e, consequentemente, de gonadotrofinas (LH e FSH). Outra opção pode passar pela administração artificial dessas hormonas do complexo hipotálamo-hipófise, interferindo diretamente no amadurecimento de vários folículos ováricos10.
Os processos de indução da ovulação não estão isentos de riscos: na verdade, há a possibilidade de desenvolver síndrome de hiperestimulação ovárica (como o nome indica, é uma situação em que, no ovário, demasiados folículos estão em processo de amadurecimento, ao mesmo tempo) devendo, neste caso, ser cancelado o ciclo1. O desrespeito por esta recomendação aumenta a probabilidade de ocorrer uma gravidez múltipla, com as complicações inerentes, quer para a mãe, quer para os fetos11.
Avaliado o estado de amadurecimento dos folículos, é administrada hCG (gonadotrofina coriónica humana), uma hormona que simula o pico de LH essencial para que ocorra a ovulação, seguindo-se a aspiração dos ovócitos libertados da estrutura folicular.
Passa-se de seguida para a avaliação da maturidade ovocitária, com base no aspeto morfológico do complexo cumulus-ovótico, o conjunto de células que é libertado aquando da ovulação, formado pelo ovócito, rodeado de células somáticas (FIGURA 2A)). Em alternativa (inclusivamente com resultados mais precisos), esta avaliação da maturidade dos gâmetas femininos pode fazer-se depois de um processo de desnudação. O processo de desnudação implica a remoção das células que circundam o ovócito, por meios enzimáticos, tornando possível a visualização do citoplasma e de estruturas extracitoplasmáticas (como o glóbulo polar, o espaço perivitelino e a zona pelúcida; FIGURA 2B)). Desta forma, consegue-se perceber em que fase da divisão meiótica se encontra o ovócito e se este apresenta sinais evidentes que indiquem anomalias genéticas ou dificuldades de sucesso na fertilização e/ou implantação12. Apesar de não se conhecer convenientemente a relação entre as anomalias extra e intracitoplasmáticas do ovócito e o sucesso reprodutivo, é conveniente que se registem todas as alterações verificadas, com vista a avaliações futuras que permitam melhorar esta técnica de diagnóstico13.
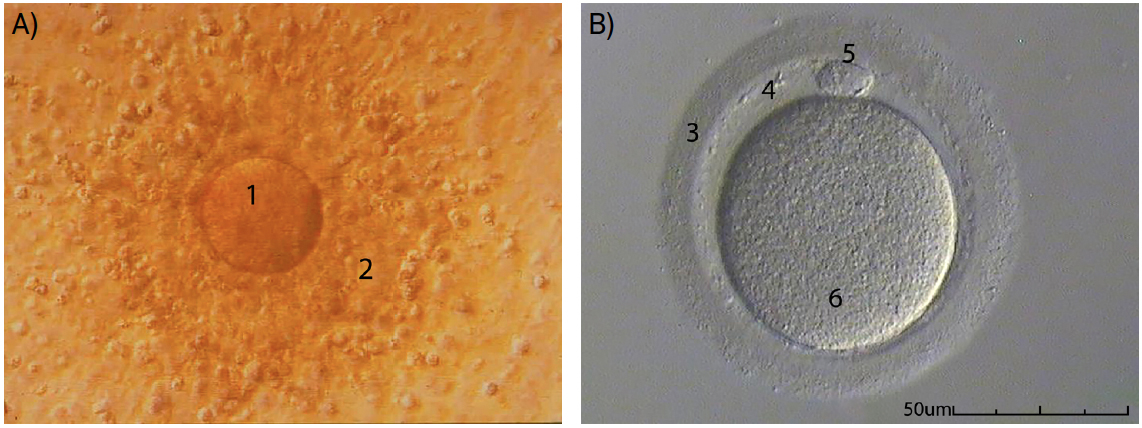
A maturidade dos ovócitos é, portanto, um pré-requisito essencial para o sucesso da fertilização e a viabilidade do embrião resultante. Na prática clínica, é costume supor que cada ovócito que exiba um glóbulo polar é um ovócito maduro em metáfase II (MII). No entanto, a observação da dinâmica dos microtúbulos durante a maturação do ovócito humano revelou que o glóbulo polar se torna visível algumas horas antes da concretização dessa fase no gâmeta feminino, podendo levar a falsas classificações e, consequentemente, reduzir as taxas de sucesso das técnicas de reprodução humana assistida. Estudos recentes demonstram os benefícios de observar o desenvolvimento do fuso meiótico (com recurso a microscópios de luz polarizada) nos ciclos de fertilização in vitro que habitualmente tenham uma resposta abaixo do ideal à estimulação convencional. Assim, otimiza- -se a determinação de amadurecimento dos ovócitos de maturação tardia e, quando necessário, adia-se a técnica para que os gâmetas femininos possam concluir a maturação in vitro, diminuindo os riscos de fertilização prematura14.
Outros estudos tentam, por outro lado, demonstrar a relação entre a expressão de determinados genes e a maturação dos ovócitos, abrindo caminhos para novas abordagens laboratoriais e afinação da avaliação. Dependem, obviamente, do desenvolvimento tecnológico que permita essa deteção em tempo útil e com boa relação custo-benefício para a prática clínica15.
Criopreservação de gâmetas e embriões
Criopreservação é o “congelamento ou vitrificação (método ultrarrápido) e armazenamento de gâmetas, zigotos, embriões ou tecido das gónadas”16.
Pretende-se, com este processo, conservar células e tecidos, armazenando-os em temperaturas abaixo de zero (-196 oC), a fim de interromper toda a atividade biológica e preservar a sua viabilidade para uso futuro. Não é uma técnica simples, pois o alto teor de água na matéria viva acarreta grande probabilidade de criação de cristais de gelo. Uma vez que os sistemas biológicos humanos não possuem mecanismos de defesa interna eficientes contra lesões causadas pelo frio, corre-se o risco de comprometer a viabilidade celular, pela possibilidade de provocar danos graves e irreversíveis nas estruturas citoplasmáticas. A expulsão de água intracelular e, consequentemente, a redução na formação de gelo dentro das células é facilitada pela exposição a crioprotetores17.
Ao longo dos anos, os cientistas propuseram diferentes estratégias de criopreservação no esforço de obter uma receita otimizada, garantindo a sobrevivência das células e, ao mesmo tempo, a manutenção das funções e habilidades fisiológicas necessárias para continuar a vida.
A criopreservação de esperma humano é uma abordagem simples e eficaz para a preservação da fertilidade masculina. É também utilizada com vista à criação de bancos de dadores masculinos. Contudo, não é uma técnica inócua, induzindo frequentemente uma diminuição notável da motilidade espermática, além de poder afetar outros parâmetros, como a integridade da membrana e do acrossoma ou a fragmentação de ADN18.
O principal método de criopreservação de espermatozoides, atualmente, é o congelamento lento convencional; no entanto, mais recentemente, a vitrificação é também usada19.
Se, para o gâmeta masculino, o processo de conservação é relativamente simples, para os gâmetas femininos há motivo de maior cuidados: ovócitos em metáfase II são notavelmente vulneráveis à criopreservação, principalmente devido ao seu grande tamanho, ao teor de água relativamente alto e à presença do fuso meiótico. Representam, por isso, os maiores desafios ao desenvolvimento de técnicas que se revelem eficazes.
Muitas mulheres procuram a conservação dos seus ovócitos por questões de saúde (antes de serem submetidas a tratamentos oncológicos, por exemplo) ou como forma de adiarem a maternidade (permitindo o acesso a gâmetas de melhor qualidade quando quiserem concretizar o sonho de ter filhos, mesmo que numa idade mais avançada)17, 20. Nos Estados Unidos da América, por exemplo, estima-se que em 2015 se tenham realizado 46.000 ciclos de reprodução assistida com o objetivo de preservar estas células reprodutoras para o futuro, contra cerca de 1.000 em 200621. Alguns cientistas, contudo, mostram preocupação pelo facto de faltarem estudos de acompanhamento de longo prazo em crianças nascidas de ovócitos congelados para avaliar convenientemente a eficácia desta técnica20.
Devido às restrições legislativas e às preocupações religiosas e éticas relativamente à produção e congelamento de embriões em grande número que não sejam implantados no útero materno durante esse ciclo, notou-se, nos últimos tempos, um aumento da investigação científica em criopreservação destas células, levando a avanços técnicos significativos, de modo que, atualmente, é reconhecido como um procedimento estabelecido e útil17, 20.
A maior parte das técnicas de reprodução humana assistida implica recolha de espermatozoides e ovócitos, fecundação fora do corpo materno e posterior transferência de embriões para o útero (FIGURA 3). Com frequência, destes processos resulta a formação de um número de embriões maior do que os que se transferem, pelo que há a necessidade de criopreservar alguns deles.
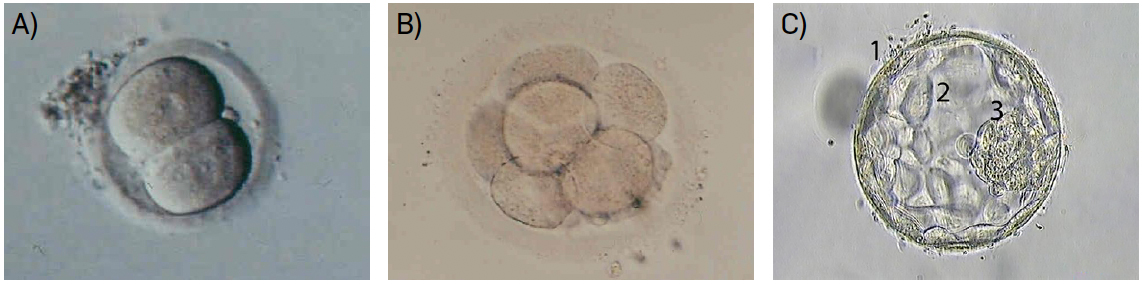
A primeira gravidez após um congelamento embrionário, com um método de preservação mais lento, ocorreu na década de 1980. Posteriormente, como já foi referido, foi desenvolvido um novo procedimento de congelamento, a vitrificação22. Este procedimento permite o armazenamento de embriões resultantes de técnicas de fertilização in vitro, com vantagens indiscutíveis: os embriões excedentários podem ser transferidos mais tarde, sem necessidade de reiniciar todo o processo de recolha de gâmetas, caso seja necessário recorrer a uma nova tentativa de gravidez ou caso o casal pretenda ter mais filhos, no futuro. Por outro lado, reservar embriões excedentários permite que não sejam transferidos mais do que um ou dois em cada ciclo, diminuindo a probabilidade de uma gravidez múltipla, com grandes riscos associados17.
Na Europa, a proporção de ciclos de transferência de embriões criopreservados em comparação com novos ciclos regista crescimentos de forma geral, estima-se que os ciclos criopreservados contribuíram para 32% das transferências em 2011 em comparação com 28% em 2010, chegando, em alguns países, a uma proporção superior a 50%23.
Em Portugal, é obrigatória a criopreservação dos embriões que não tenham sido transferidos, desde que tenham características adequadas para tal. Não poderá haver lugar a um novo ciclo de FIV (fertilização in vitro) a fresco, sem que tenha sido tentada a transferência de todos os embriões criopreservados desse casal1. Contudo, este procedimento implica questões bioéticas muito prementes: é fundamental refletir sobre qual o destino a dar aos inúmeros embriões excedentários que resultam dos vários ciclos de tratamento e que nunca chegam a ser implantados.
A criopreservação de gâmetas e de embriões assenta em tecnologias cada vez mais desenvolvidas e diversos estudos revelam que as taxas de sucesso, nestas situações, são comparáveis às obtidas com gâmetas novos24, 25.
Agradecimentos
Esta investigação foi apoiada por fundos nacionais através da FCT — Fundação para a Ciência e Tecnologia no âmbito da UIDB/04423/2020 e UIDP/04423/2020.
Referências
- 1 DGS, Saúde Reprodutiva - Infertilidade - Cuidados de Saúde Hospitalares, (DGS, ed.), Lisboa. 2011.
- 2 MASCARENHAS, M. N. et al., National, Regional, and Global Trends in Infertility Prevalence Since 1990: A Systematic Analysis of 277 Health Surveys, PLoS Med., 9, 12. 2012. DOI: 10.1371/journal.pmed.1001356.
- 3 PATRÃO N. M. C. & OSSWALD, W., Bioética Simples, Bioética Simples, Lisboa: Verbo. 2014.
- 4 DE GEYTER, C. et al., ART in Europe, 2014: Results generated from European registries by ESHRE,, Hum Reprod., 33, 9, 1586-1601. 2018. DOI: 10.1093/humrep/dey242.
- 5 WHO, Laboratory Manual for the Examination and Processing of Human Semen, Laboratory Manual for the Examination and Processing of Human Semen
- 6 ZANETTI, B. F. et al., Sperm morphological normality under high magnification is correlated to male infertility and predicts embryo development, Andrology, 6, 3, 420-427. 2018. DOI: 10.1111/andr.12473.
- 7 KARIMIM N. et al., DGC/ Zeta as A New Strategy to Improve Clinical Outcome in Male Factor Infertility Patients following Intracytoplasmic Sperm Injection: A randomized, single-blind, clinical trial, Cell J., 22, 1, 55-59. 2020. DOI: 10.22074/ cellj.2020.6525.
- 8 GIANZO, M. et al., Human sperm testicular angiotensin?converting enzyme helps determine human embryo quality, Asian J Androl, 20, 498-504. 2018. DOI: 10.4103/aja.aja.
- 9 ALLOW, A. K. et al., Distribution of Infertility Factors among Infertile Couples in Yemen, J Clin Dev Biol., 1, 3, 1-4. 2016. DOI: 10.4172/2472-1964.10000011.
- 10 SAMPAIO, M. G., Orientações Técnicas Em Medicina Da Reprodução, Lisboa: Sociedade Portuguesa de Medicina da Reprodução, 35-49. 2012.
- 11 DANHOF, N. A. et al., IUI for unexplained infertility — a network meta-analysis, Hum Reprod Update, 26, 1, 1-15. 2019. DOI: 10.1093/humupd/dmz035.
- 12 TAYLOR, T. H. et al., Effect of denuding on polar body position in in-vitro matured oocytes, Reprod Biomed Online, 17, 4, 515-519. 2008. DOI: 10.1016/S1472-6483(10)60238-6.
- 13 ALMEIDA, V. et al., Orientações Técnicas Em Medicina Da Reprodução, Lisboa: Sociedade Portuguesa de Medicina da Reprodução, 120-155. 2012.
- 14 HOLUBCOVÁ, Z. et al., Egg maturity assessment prior to ICSI prevents premature fertilization of late-maturing oocytes, J Assist Reprod Genet, 36, 445-452. 2019. DOI: 10.1007/s10815-018-1393-0.
- 15 CHOKJIRAWAT, T. et al., Luteinizing Hormone Receptor Gene and Regulator of G?protein Signaling 2 Gene Expression Level and Association with Oocyte Maturity in In vitro Fertilization/Intracytoplasmic Sperm Injection Cycle, J Hum Reprod Sci., 11, 1, 52-58. 2018. DOI: 10.4103/jhrs.JHRS.
- 16 ZEGERS-HOCHSCHILD, F. et al., The International Committee for Monitoring Assisted Reproductive Technology (ICMART) and the World Health Organization (WHO) Revised Glossary on ART Terminology , 2009, Hum Reprod., 24, 11, 2683-2687. 2009. DOI: 10.1093/humrep/dep343.
- 17 EDGAR, D. H. & GOOK, D. A., A critical appraisal of cryopreservation (slow cooling versus vitrification) of human oocytes and embryos, 18, 5, 536-554. 2012. DOI: 10.1093/humupd/dms016.
- 18 FU, Q. et al., Quantitative proteomic characterization of human sperm cryopreservation: using data-independent acquisition mass spectrometry, BMC Urol, 19, 133. 2019. DOI: 10.1186/s12894-019-0565-2.
- 19 KARTHIKEYAN, M., Comparison of Conventional Slow Freeze versus Permeable Cryoprotectant?Free Vitrification of Abnormal Semen Sample: A Randomized Controlled Trial, J Hum Reprod Sci., 12, 2, 150-155. 2019. DOI: 10.4103/jhrs. JHRS_154_18.
- 20 IUSSIG, B. et al., A brief history of oocyte cryopreservation: Arguments and facts, Acta Obstet Gynecol Scand, 98, 550-558. 2019. DOI: 10.1111/aogs.13569.
- 21 BEAUJOUAN, É. & SOBOTKA, T., Late childbearing continues to increase in developed countries, Popul Soc., 38, 562, 38-41. 2019.
- 22 GALINDO, R. C. R. et al., Tasa de gestación y niveles de ? HCG en transferencia de embriones congelados y frescos, Rev Cuba Obstet y Ginecol, 44, 3. 2018.
- 23 RIENZI, L. et al., Oocyte, embryo and blastocyst cryopreservation in ART: systematic review and meta-analysis comparing slow-freezing versus vitrification to produce evidence for the development of global guidance, Hum Reprod Update, 23, 2, 139-155. 2017. DOI: 10.1093/humupd/dmw038.
- 24 RODRIGUEZ-WALLBERG, K. A., Ice age: Cryopreservation in assisted reproduction – An update, Reprod Biomed Online, 37, 1, 1-3. 2018. DOI: 10.1016/j.repbio.2019.04.002.
- 25 ALIKANI, M., Cryostorage of human gametes and embryos: a reckoning, Reprod Biomed Online, 37, 1, 1-3. 2018. DOI: 10.1016/j.rbmo.2018.05.004.
Este artigo já foi visualizado 4969 vezes.



