Biofilmes em superfícies industriais
📧 , 📧 , 📧 , 📧 , 📧
- * CEB/ Universidade do Minho
- ɫ LEPABE/ Universidade do Porto
- ‡ CIMO/ Instituto Politécnico de Bragança
- + CITAB/ Universidade de Trás-os-Montes e Alto Douro
- # LEPABE/ Universidade do Porto
Referência Simões, L. C., Gomes, I. B., Fernandes, C., Saavedra, M. J., Simões, M., (2022) Biofilmes em superfícies industriais, Rev. Ciência Elem., V10(1):017
DOI http://doi.org/10.24927/rce2022.017
Palavras-chave biofilmes benéficos, biofilmes indesejáveis, formação de biofilme, indústria, microrganismos
Resumo
A sobrevivência dos mais aptos é um princípio biológico aplicável a todos os seres vivos e, embora organismos diferentes tenham desenvolvido mecanismos próprios para maximizar as suas hipóteses de sobrevivência, todos possuem um fator comum — a sobrevivência está diretamente relacionada com a capacidade de adaptação às variações das características do meio ambiente. As bactérias são particularmente adaptáveis a tais variações, em virtude da sua taxa de reprodução extremamente elevada, o que lhes permite a transferência de características de sobrevivência para gerações futuras em períodos de tempo muito curtos. Adicionalmente, muitas espécies bacterianas têm uma tendência natural para se fixar a superfícies, multiplicar e incorporar numa matriz viscosa produzida pelos microrganismos colonizadores, formando biofilmes1.
Estes biofilmes podem ser encontrados praticamente em qualquer material que esteja em contacto com água, podendo a sua formação ser desejável ou indesejável. De facto, a organização de células microbianas em biofilme, particularmente as bacterianas, é supostamente a primeira forma de vida multicelular existente no planeta, sendo estimado que a maioria das bactérias estejam organizadas em biofilmes2. Estas estruturas microbianas podem ocorrer em ambientes extremos, como em fontes hidrotermais, centrais nucleares e tubagens industriais sujeitas a forte desinfeção. Contudo, a existência de biofilmes só foi documentada pela primeira vez em 1943 por Zobell3, que observou células microbianas aderidas em paredes de garrafas. Posteriormente, atribuíram o termo filme microbiano ou biológico à camada gelatinosa de células e dos seus subprodutos aderidos às paredes de um biorreator4. Topiwala5 e Hamer6 observaram camadas de células bacterianas e as suas substâncias poliméricas extracelulares que designaram como crescimento de parede. Characklis7, 8 publicou uma extensa revisão bibliográfica sobre os fundamentos básicos e as implicações práticas dos biofilmes, utilizando a designação lama microbiana.
Em 1984, um consenso dos principais investigadores na área definiu um biofilme como um conjunto de microrganismos, predominantemente bactérias, embebidos numa matriz tridimensional gelatinosa de polímeros extracelulares excretados pelos microrganismos colonizadores9. Quando a formação de um biofilme é indesejável, este fenómeno é também designado por sujamento biológico ou biofouling10. A FIGURA 1 apresenta um biofilme formado numa superfície e a sua microestrutura.

Importa então esclarecer que a ciência dos biofilmes é uma disciplina técnica relativamente nova, que surgiu fundamentalmente para dar resposta à necessidade de métodos para o controlo de biofilmes. No entanto, a maior parte do trabalho já desenvolvido incidiu essencialmente nos problemas provocados pelos biofilmes médicos. Esses têm uma reputação drasticamente pior do que os encontrados na indústria, devido ao simples facto de que os biofilmes médicos podem matar — mais de 65% de todas as infeções microbianas em humanos são causadas por biofilmes11, 12.
As superfícies parecem desempenhar um papel de grande importância na sobrevivência das células microbianas, independentemente de se tratar de células eucarióticas ou procarióticas13, 14, 15. São vários os fatores que contribuem para que a adesão dos microrganismos à superfície represente uma vantagem ecológica e uma estratégia de sobrevivência, destacando-se: i) a maior concentração de nutrientes junto à superfície; ii) a velocidade de escoamento do fluido — é mínima junto à superfície. Contudo, o processo de formação e o comportamento do biofilme são relativamente estocásticos. A formação de biofilmes em sistemas industriais é um processo complexo que depende de variáveis processuais que influenciam a atividade metabólica, individual e coletiva, e a replicação dos microrganismos16, 17. De particular importância são o tipo de microrganismos presentes e as suas interações, as condições hidrodinâmicas do fluido, o tipo de material da superfície de adesão e o seu estado de conservação, a temperatura (do fluido e da superfície), a concentração de nutrientes, a presença de material orgânico e inorgânico na superfície e em suspensão, e a presença/ausência de desinfetante16, 17. Estas variáveis têm um papel de relevo na formação do biofilme, nas suas características e na sua tolerância a desinfetantes (FIGURA 2).
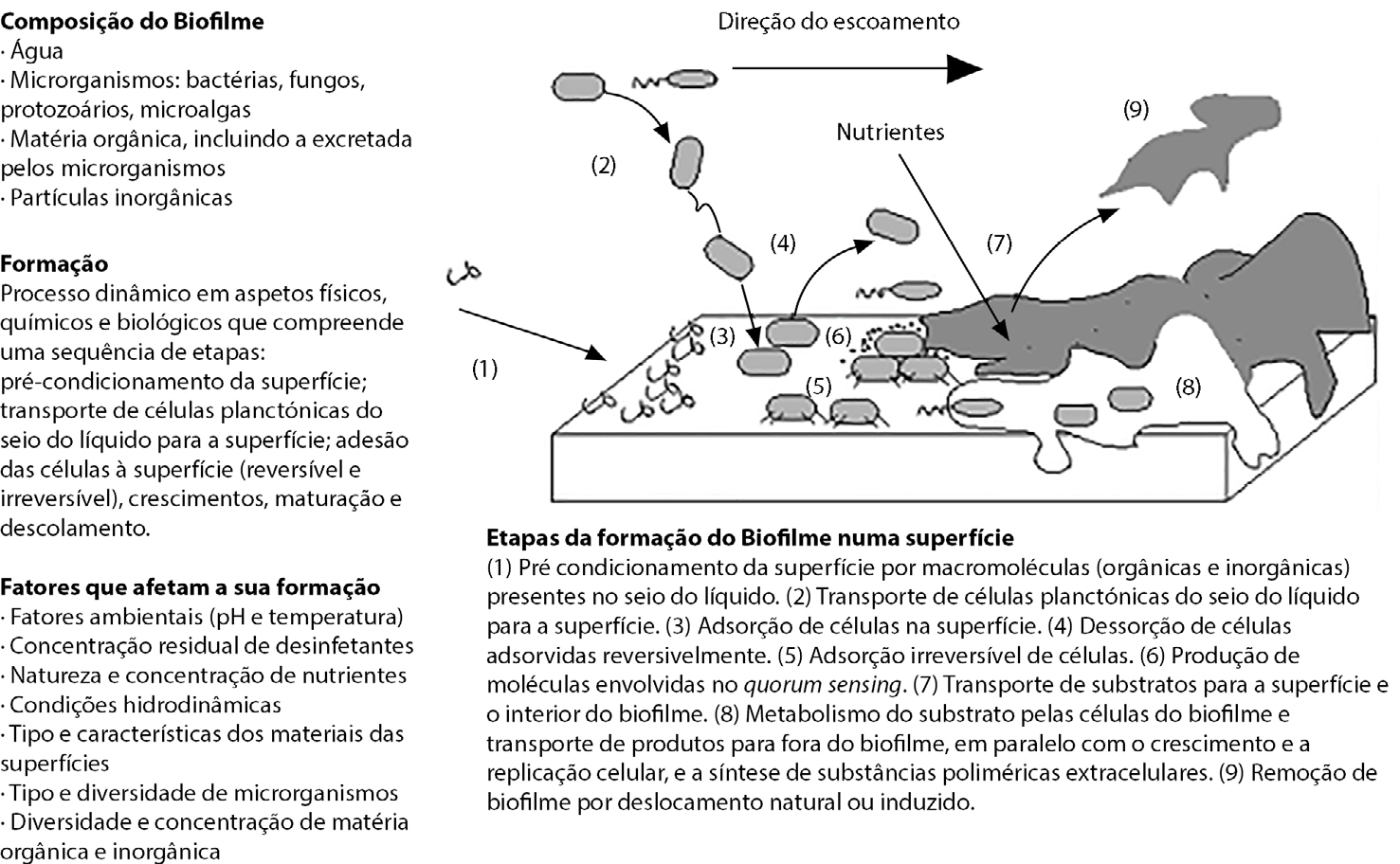
Uma vez formado, o biofilme apresenta uma organização celular complexa que lhe confere níveis de tolerância a produtos antimicrobianos muito superiores aos das mesmas células em estado planctónico (células mantidas em suspensão). Estima-se que as células em biofilmes podem ter uma tolerância antimicrobiana 1000 vezes superior à das mesmas células em estado planctónico18.
Portanto, apesar das enormes perdas económicas decorrentes da formação de biofilmes em sistemas industriais, esses são considerados secundários e a sua desinfeção é realizada sem um conhecimento claro da eficiência dos biocidas no controlo de biofilmes. Salvo problemas processuais, i.e, biocorrosão, limitação à transferência de calor, perda de carga ou queda de pressão, os biofilmes não são tidos como problemáticos para a qualidade e segurança do produto final desde que não se descolem da superfície onde estão aderidos. Uma vez descolados da superfície, importa controlar a carga microbiológica no seio da fase líquida. Desta forma, é fundamental manter uma concentração residual de desinfetante no seio do líquido como estratégia de controlo dos microrganismos planctónicos13. Esta prática é corrente, por exemplo, no controlo da qualidade microbiológica da água potável.
Os biofilmes podem, contudo, ser utilizados com um carácter benéfico. Como exemplo de biofilmes benéficos temos aqueles que se acumulam em ambientes naturais nos depósitos dos rios, lagos ou ambientes marinhos, e que se desenvolvem em associação com as raízes de algumas plantas fornecendo-lhes alguns nutrientes19. São também biofilmes benéficos aqueles que são utilizados em biotecnologia ambiental, com grande sucesso no tratamento de efluentes, removendo poluentes orgânicos e inorgânicos de águas contaminadas e na biorremediação de substâncias potencialmente tóxicas. Na indústria alimentar os biofilmes apresentam inúmeras vantagens, podendo ser utilizados na produção de alimentos fermentados, como por exemplo, a produção de vinagre por oxidação biológica do etanol20, de ácido cítrico e na produção de sherry21. Como exemplo de outros produtos de interesse industrial obtidos usando biofilmes destaca-se a produção de polímeros extracelulares, nomeadamente o alginato e o gelano (polissacáridos de interesse industrial)22, e também a produção de vacinas e hormonas23, 24. Aplicações farmacêuticas através da produção de metabolitos secundários, e processos biológicos para a extração de metais a partir de minério são exemplos de outros bioprocessos onde o uso de microrganismos em biofilmes é relevante25. Na indústria, os reatores de biofilme apresentam vantagens relativamente aos reatores de biomassa suspensa, uma vez que permitem uma maior retenção da biomassa e a operação com tempos de residência mais baixos. Isto é relevante quando se utilizam correntes de alimentação muito diluídas ou microrganismos com taxas de replicação baixas, cujo crescimento em suspensão requer tempos de residência significativos. Além disso, os reatores de biofilme são mais estáveis em condições transitórias, caracterizadas pela existência de flutuações no caudal e na composição do fluido de alimentação, e requerem um menor volume processual e área de implementação26.
Os biofilmes desempenham um papel importante na natureza e em processos biotecnológicos. Do ponto de vista do interesse do Homem podem ser benéficos ou prejudiciais, donde resulta a necessidade do seu estudo para permitir o desenvolvimento de estratégias para melhorar as suas características, caso eles sejam benéficos, ou para o eliminar ou inibir a sua formação, quando a sua ação é prejudicial.
Agradecimentos
Este trabalho foi financiado por: Financiamento Base — UIDB/00511/2020 da Unidade de Investigação — Laboratório de Engenharia de Processos, Ambiente, Biotecnologia e Energia — LEPABE — financiado por fundos nacionais através da FCT/MCTES (PIDDAC); Financiamento Base — UIDB/04469/2020 da Unidade de Investigação Centro de Engenharia Biológica — financiado por fundos nacionais através da FCT/MCTES (PIDDAC); financiamento CIMO (UIDB/00690/2020) através de fundos nacionais FCT/MCTES; Financiamento Base — UIDB/04033/2020 da Unidade de Investigação — Centro de Investigação e Tecnologias Agroambientais e Biológicas — CITAB — financiado por fundos nacionais através da FCT/MCTES (PIDDAC); BioTecNorte (NORTE-01-0145-FEDER-000004) no âmbito do Programa Operacional Regional do Norte — Norte2020; Projetos: Biocide_for_Biofilm — PTDC/BII-BTI/30219/2017 — POCI-01-0145-FEDER-030219; AlgaValor — POCI-01-0247-FEDER-035234; LISBOA-01-0247-FEDER-035234; ALG-01-0247-FEDER-035234; pBio4.0 — POCI-01-0247-FEDER-033298; Germirrad — POCI-01-0247-FEDER-072237, financiados pelo Fundo Europeu de Desenvolvimento Regional (FEDER), através do COMPETE2020 – Programa Operacional Competitividade e Internacionalização (POCI) e com o apoio financeiro da FCT/MCTES através de fundos nacionais (PIDDAC) e ANI.
Referências
- 1 SCHOPF, J. et al., Earth’s earliest biosphere: Its Origin and Evolution, Princeton Univ. Press., USA. 1983.
- 2 COSTERTON, J. W. et al., Bacterial biofilms in nature and disease, Annu Rev Microbiol, 41, 435—64. 1987.
- 3 ZOBELL, C. E., The effect of solid surfaces upon bacterial activity, J Bacteriol, 46, 39—56. 1943.
- 4 ATKINSON, B. et al., Kinetics, mass transfer and organism growth in a biological film reactor, Transact Inst Chem Eng, 46, T257—T264. 1967.
- 5 TOPIWALA, H. H. & HAMER, G., Effect of wall growth in steady-state continuous cultures, Biotechnol Bioeng, 13, 919—922. 1971.
- 6 HOWELL, J. A. et al., Effect of wall growth on scale-up problems and dynamic operating characteristics of the biological reactor, Biotechnol Bioeng, 14, 253—265, 1972.
- 7 CHARACKLIS, W. G., Attached microbial growths—I. Attachment and growth, Water Res, 7, 1113—1127. 1973.
- 8 CHARACKLIS, W. G., Attached microbial growths—II. Frictional resistance due to microbial slimes, Water Res, 7, 1249—1258. 1973.
- 9 MARSHALL, K. C., Dahlem Workshop on Microbial Adhesion and Aggregation Berlin, Berlin: Springer—Verlag. 1984.
- 10 BOTT, T. R., Industrial Biofouling. Elsevier, Amsterdam, p 1—5. 2011.
- 11 BORGES, A. et al., New perspectives on the use of phytochemicals as an emergent strategy to control bacterial infections including biofilms, Molecules, 21. 2016.
- 12 SHUNMUGAPERUMAL, T., Biofilm Eradication and Prevention, John Wiley & Sons, Inc., p 1—35. 2010.
- 13 SIMÕES, L. C. & SIMÕES, M., Biofilms in drinking water: problems and solutions, RSC Adv, 3, 2520—2533. 2013.
- 14 BARROS, A. C. et al., Microalgal/cyanobacterial biofilm formation on selected surfaces: the effects of surface physicochemical properties and culture media composition, J Appl Phycol, 31, 375—387. 2019.
- 15 FERNANDES, S. et al., Adhesion of filamentous fungi isolated from drinking water under different process conditions, Water Res, 164, 114951. 2019.
- 16 DEINES, P. et al., A new coupon design for simultaneous analysis of in situ microbial biofilm formation and community structure in drinking water distribution systems, Appl Microbiol Biotechnol, 87, 749—56. 2010.
- 17 SIMÕES, M. et al., A review of current and emergent biofilm control strategies, LWT — Food Sci Technol, 43, 573—583. 2010.
- 18 SIMÕES, M., Antimicrobial strategies effective against infectious bacterial biofilms, Curr Med Chem, 18, 2129—45. 2011.
- 19 CHAVES, L., Estudo da cinética de formação de biofilmes em superfícies em contacto com água potável, Universidade do Minho: Escola de Engenharia. 2004.
- 20 MELO, L., Biofilmes e o Controlo da Poluição, Boletim de Biotecnologia, 48, 16—25. 1994.
- 21 GJALTEMA, A., XXX, Technische Universiteit Delft: The Netherlands. 1996.
- 22 GONZALEZ—CUELLO, E. et al., Optimization of the mechanical properties of biofilm based on alginate — gellan plasticized with glycerol, Contemp Eng Sci, 11, 891—905. 2018.
- 23 HARRO, J. M. et al., Vaccine development in Staphylococcus aureus: taking the biofilm phenotype into consideration, FEMS Immunol Med Microbiol, 59, 306—23. 2010.
- 24 NEUMAN, H. et al., Microbial endocrinology: the interplay between the microbiota and the endocrine system, FEMS Microbiol Rev, 39, 509—21. 2015.
- 25 XAVIER, J. B. et al., Monitorização e modelação da estrutura de biofilmes, Boletim de Biotecnologia, 2—13. 2003.
- 26 VIEIRA, M. J. & OLIVEIRA, R., Reactores Biológicos Fundamentos e Aplicações, Lidel — Edições Técnicas, Lda., p 393—409. 2007.
Este artigo já foi visualizado 2710 vezes.



