O peixe-zebra (Danio rerio) como modelo emergente na ecotoxicologia
📧 , 📧 , 📧 , 📧 , 📧 , 📧
- * UTAD
- ɫ UTAD
- ‡ UTAD
- + UTAD
- # UTAD
- § Universidade do Porto
Referência Ribeiro, O. M., Pinto, M. Q., Félix, L., Monteiro, S. M., Fernandes, A. F., Carrola, J. S., (2022) O peixe-zebra (Danio rerio) como modelo emergente na ecotoxicologia, Rev. Ciência Elem., V10(2):021
DOI http://doi.org/10.24927/rce2022.021
Palavras-chave Peixe-zebra, ecotoxicologia, poluição, bem-estar, desenvolvimento embrionário
Resumo
A libertação de poluentes tradicionais e emergentes nos ecossistemas aquáticos tem levado à contaminação da água e sedimentos, o que pode afetar a saúde dos animais selvagens, das suas populações e contaminar as cadeias alimentares com consequências na ecologia, mas também na saúde pública. Estes diversos compostos tóxicos (incluindo os lipossolúveis e persistentes) podem chegar aos ecossistemas através de diferentes vias e os seus efeitos da exposição aguda e/ou crónica nos organismos não-alvo ainda não são bem compreendidos. Assim, torna-se importante implementar medidas de monitorização da poluição aquática e de estudos ecotoxicológicos usando diversos organismos, desde algas, invertebrados e vertebrados, como por exemplo os peixes, para perceber quais os efeitos dos tóxicos emergentes em vários níveis de organização biológica. O peixe-zebra apresenta numerosas vantagens que o tornaram num modelo vertebrado fundamental, sendo muito utilizado em todo o mundo. Existem numerosos protocolos (desenvolvidos desde 1980), incluindo as Diretrizes 203 da OCDE publicadas a partir de 1992, que permitem avaliar a ecotoxicidade dos contaminantes em amostras de água, efluentes e sedimentos. Desta forma, é possível investigar os efeitos no desenvolvimento (embriogénese/teratogénese), anatomia, biomarcadores (moleculares, bioquímicos, genéticos e histológicos), fisiologia, imunologia, reprodução, comportamento e bioacumulação etc.. Assim, a combinação das análises físico-químicas clássicas e o peixe zebra (embriões, larvas e adultos) pode fornecer informação valiosa do risco potencial dos tóxicos nos ecossistemas aquáticos, mas não devemos esquecer a implementação de testes que sejam ecologicamente relevantes, testes in situ e uso de espécies piscícolas nativas e/ou não tropicais.
A poluição aquática é um problema preocupante à escala mundial, em particular para os ecossistemas de água doce. Um elevado número de compostos químicos de vários tipos, exercem efeitos tóxicos nos organismos aquáticos, contaminando as cadeias alimentares e afetando também os vários usos da água, como por exemplo irrigação na agricultura, recreação e água potável destinada ao consumo humano4.
As análises químicas são indispensáveis para avaliar a contaminação da água, no entanto, é necessário estudar o impacto desses xenobióticos nos vários organismos vivos, de forma a estimar os efeitos ecotoxicológicos mais complexos a médio e longo prazo. Assim, a ecotoxicologia torna-se importante, na medida em que investiga os efeitos dos tóxicos (naturais ou sintéticos) nos microrganismos, na flora e na fauna, nomeadamente nos organismos selvagens e suas populações, comunidades, ecossistemas e biosfera. A ecotoxicologia visa implementar uma abordagem mais integrativa com o estudo da distribuição, destino dos tóxicos, e concentrações dos tóxicos nas cadeias alimentares incluindo a avaliação dos efeitos nocivos nos vários níveis de organização biológica48, 9. Para isto, são usadas diferentes metodologias, desde os estudos de campo, mesoscosmos, microcosmos, até estudos mais controlados realizados em laboratório como testes in vitro e in vivo (FIGURA 1)30, 39, seguindo as diretrizes dos testes da Organização para a Cooperação e Desenvolvimento Econômico (OCDE/OECD) e Organização Internacional de Normalização (OIN/ISO).
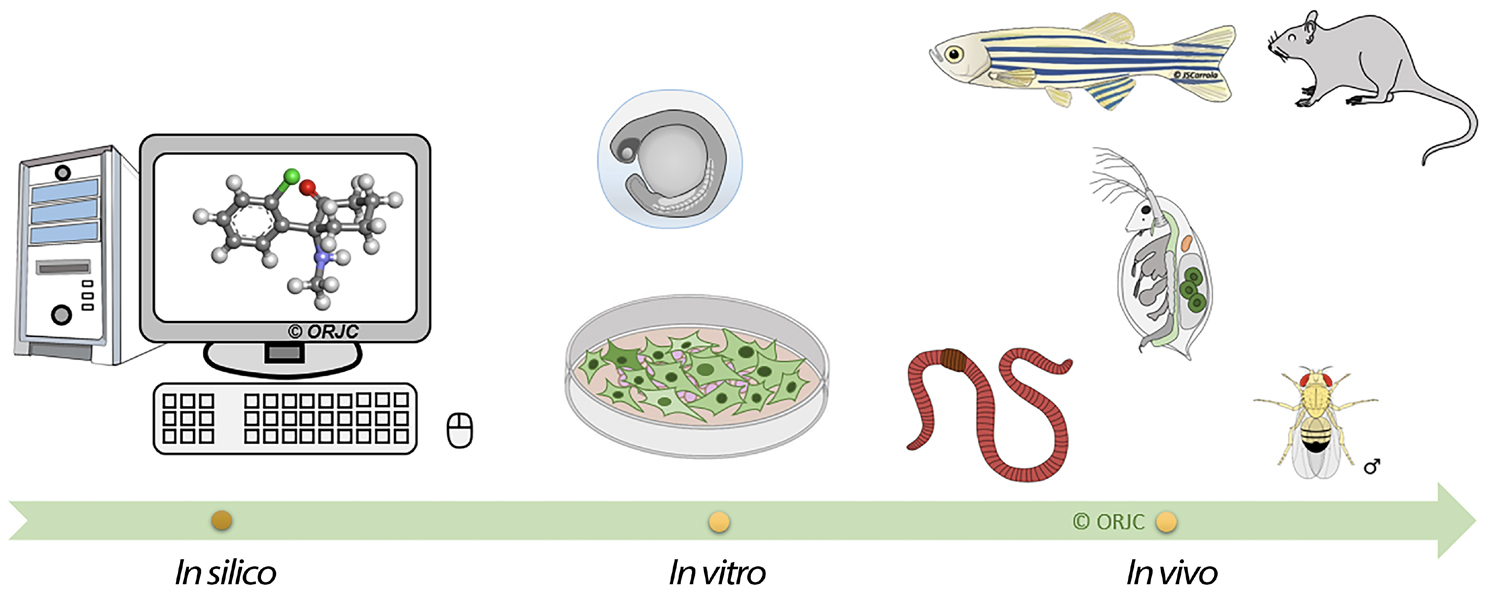
Os testes in silico recorrem à bioinformática e inteligência artificial para estimar, numa primeira fase, os potenciais efeitos tóxicos de novas moléculas/substâncias recorrendo a programas informáticos sofisticados, reduzindo assim o uso de modelos animais.
Os ensaios in vitro correspondem a estudos realizados “fora” dos organismos vivos, em que se utiliza normalmente células, tecidos ou órgãos isolados em condições laboratoriais. Estes ensaios correspondem a um indicador inicial do efeito tóxico e reduzem consideravelmente o uso de modelos animais. Os ensaios in vivo são realizados com modelos animais criados em laboratório para realizar estudos mais específicos e que permitem avaliar a interação entre células, órgãos e sistemas com efeitos dinâmicos muito complexos. São utilizados diferentes organismos vivos38, com distintas complexidades metabólicas e neurológicas o que permite estudar efeitos farmacológicos32, neurotóxicos, comportamentais33, 35, imunotóxicos, genotóxicos37, oncológicos entre outros.
Bem-estar animal
Atualmente, a utilização de animais vivos deve ser reduzida o mais possível, em particular os animais incluídos na legislação. O uso de modelos animais para experimentação deve ser autorizada pelo Órgão Responsável pelo Bem-Estar dos Animais (ORBEA) da instituição respetiva e pela Direção-Geral de Alimentação e Veterinária (DGAV) e deve ser realizada por pessoas devidamente treinadas e com experiência nas espécies utilizadas. Além das autorizações pelos órgãos competentes, estes ensaios devem seguir as diretrizes e legislação em vigor sobre proteção dos animais (Diretiva da União Europeia 2010/63/EU), transcrita para a legislação nacional (Decreto-Lei n.º113/2013), que integra o conceito dos 3Rs — substituição (Replacement), refinamento (Refinement) e redução (Reduction)41. É importante definir os human endpoints no início de cada ensaio de forma a minimizar o sofrimento ou dor dos animais cumprindo com a legislação.
Avaliação dos efeitos dos tóxicos
É importante realizar estudos de campo, numa vertente de monitorização e biomonitorização, in loco, para detetar e quantificar a presença de tóxicos no solo, sedimentos, água e nos tecidos dos organismos48 bem como os efeitos nos organismos terrestres13, 36 e aquáticos23, 50. Pode-se recorrer à recolha de amostras de água, sedimentos e/ou solo para análises físico-químicas. Pode-se ainda recolher amostras de fluidos (sangue ou urina) ou tecidos de animais, de forma a determinar a bioacumulação, bioconcentração (a concentração do tóxico ou toxina no bivalve é muito superior ao valor presentes na água) ou bioamplificação (aumento da concentração dos tóxicos ao longo da cadeia alimentar contribuindo para valor alto nos animais do topo) dos xenobióticos16, 20.
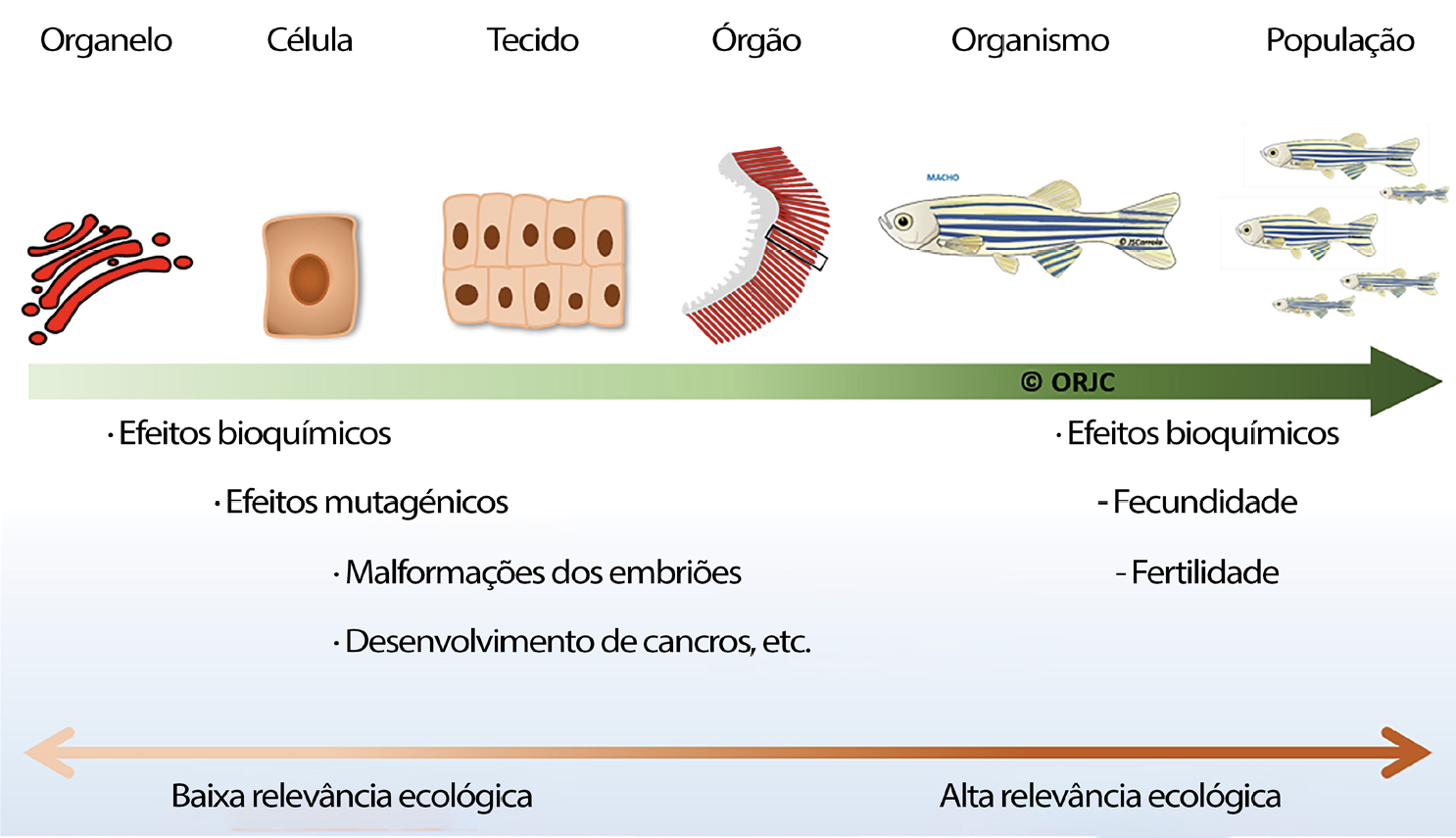
Complementarmente, em cada organismo podem ser estudados os efeitos dos xenobióticos em diferentes níveis de organização biológica tais como, ao nível molecular, celular, bioquímico, genético, imunológico, histológico, órgão, organismo (reprodução, desenvolvimento e comportamento), população, comunidade, etc. (FIGURA 2).
Os peixes são considerados bons bioindicadores do estado ecológico da água devido à sua importância ecológica (presa/predador), constante exposição aos compostos tóxicos presentes na água, sedimentos e alimentos, e à sua elevada sensibilidade nas fases inicias de vida (ovos, larvas e alevins) e também como fonte alimentar vital para o Homem. Neste caso a ictiofauna é um elemento fundamental na biomonitorização o que permite ter uma perceção mais real do que acontece aos indivíduos e às populações nos ecossistemas onde vivem5, 6.
Estes estudos são mais complexos tendo em conta as variáveis que afetam o peixe e por isso alguns estudos são complementados em laboratório.
Os estudos em laboratório permitem avaliar de forma controlada os efeitos de compostos tóxicos puros (misturas simples com 2 ou 3 compostos, ou de misturas complexas como efluentes de industrias ou ETARs) e os seus efeitos em diferentes níveis de organização biológica. Neste contexto, existem determinadas espécies de peixes propostas para estudos de toxicologia e ecotoxicologia em laboratório24, como a truta (Oncorhynchus mykiss), peixe-zebra (Danio rerio), medaka (Oryzias latipes), vairão-de- -cabeça-gorda (Pimephales promelas), o esgana-gata (Gasterosteus aculeatus). Outras espécies podem ser utilizadas como a tilápia (Oreochromis niloticus)11, 33 e guppy (Poecilia reticulata)1.
Entre as espécies mais pequenas destaca-se claramente D. rerio por ser um modelo animal muito utilizado na maioria dos centros de investigação ligados à ecotoxicologia aquática10, 49 e às ciências biomédicas12, 43, 51. O interesse por esta espécie cresceu imenso nas últimas décadas tal como se pode verificar facilmente pelo número de artigos científicos publicados e atualmente é uma espécie de referência na toxicologia e é muito utilizada na ecotoxicologia. É de realçar que é importante realizar também testes com organismos endémicos de maneira a entender de forma mais realista quais os efeitos reais para estas espécies nativas o que pode afetar as cadeias alimentares e os ecossistemas contaminados.
O peixe-zebra como modelo nos estudos ecotoxicológicos
D. rerio, ao longo dos anos, tem sido muito utilizado em diversas áreas de investigação como na genética, ecotoxicologia, toxicologia, biologia do desenvolvimento, teratologia, biomedicina, etologia e carcinogénese, entre outros, tornando-se assim num dos organismos modelo mais utilizados21, 42.
Devido à importância da utilização do peixe-zebra no estudo da poluição aquática foram desenvolvidas diretrizes/protocolos tanto pela OCDE, como pela Organização Internacional de Padronização (ISO). Foram elaborados protocolos pela OCDE para avaliar a toxicidade aguda dos compostos químicos — Ensaio 20329 e Ensaio 21025, crescimento — Ensaio 21527 e para avaliar os efeitos a curto prazo nos estágios iniciais de vida — Ensaios 21226. Em 2008 foram realizadas modificações e propostas novas diretrizes que incluem parâmetros mais sofisticados para a avaliação da ecotoxicidade, que dão mais importância ao modo de ação específico dos compostos ou para estudos completos do ciclo de vida — Ensaio 9528. Já a ISO criou diretivas para determinar a toxicidade aguda de águas residuais em ovos de peixe-zebra (Danio rerio) — ISO 15088, determinar a toxicidade para embriões e larvas de peixes de água doce — ISO 12890, determinar a toxicidade letal aguda de substâncias em peixes de água doce (Brachydanio rerio Hamilton-Buchanan (Teleostei, Cyprinidae)) — ISO 7346 e avaliar a toxicidade de nanomateriais em embriões de peixe-zebra dechorionados — ISO 22082.
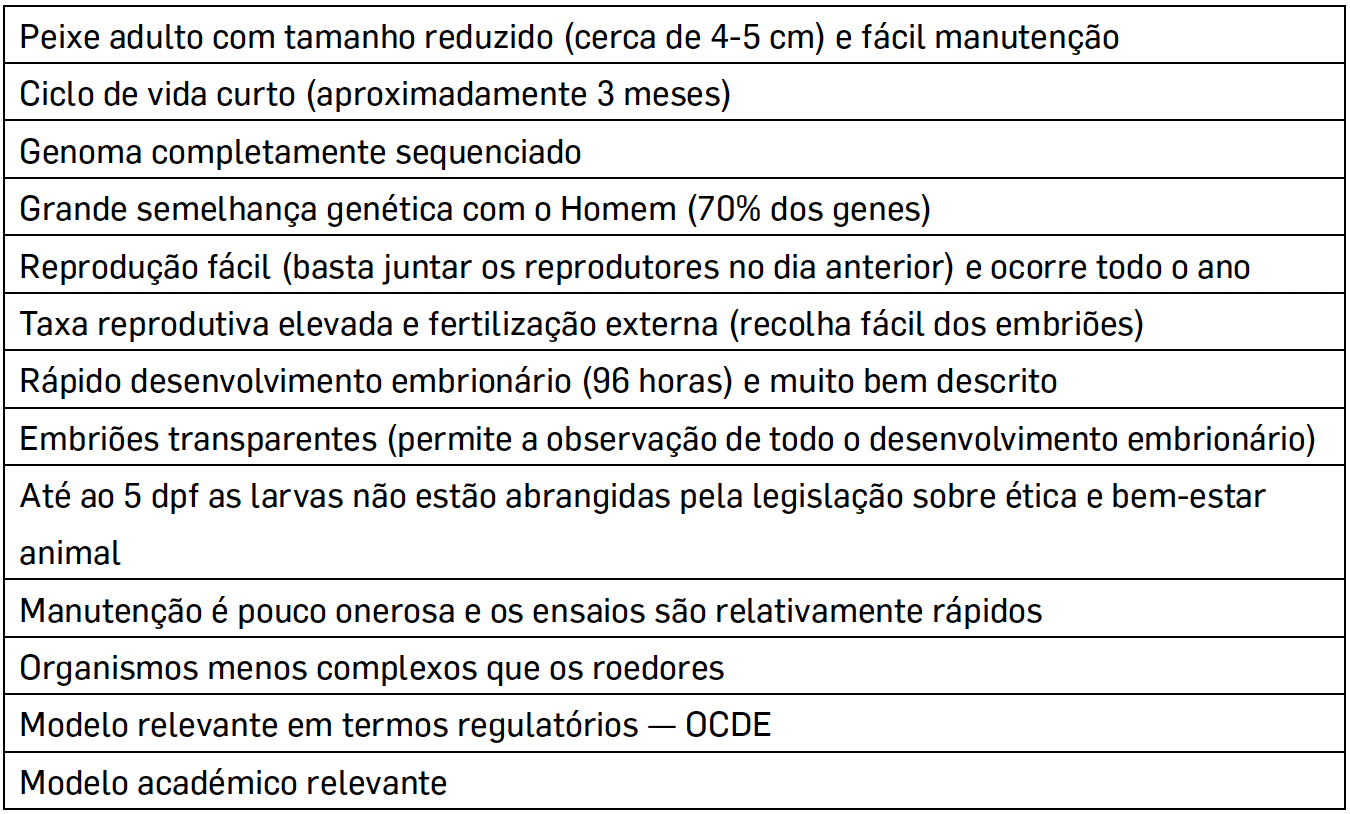
Durante os primeiros estágios de vida do peixe-zebra (5 dpf — dias após fertilização), a sua utilização na investigação não está abrangida pelas diretrizes de ética e bem-estar animal. Sendo considerado uma alternativa aos ensaios em mamíferos8, como método de substituição ou refinamento19. Apesar do peixe-zebra ser muito diferente morfologicamente do homem, compartilha uma variedade de genes e vias evolutivamente conservadas com outros vertebrados e possui 70% do genoma semelhante ao do Homem15. A sua vasta e intensa utilização nas várias linhas de investigação deve-se a um conjunto de vantagens, como explicado na TABELA 1.
Apesar das vantagens da utilização do peixe-zebra como organismo modelo para avaliar os efeitos dos compostos tóxicos, também existem algumas limitações ao seu uso. Por exemplo, é muito distante dos humanos do que outros modelos animais, como roedores, uma vez que o último ancestral comum foi há 445 milhões de anos. Como não é um mamífero, não é possível controlar totalmente a dose química absorvida, uma vez que os embriões não se desenvolvem dentro da placenta7, e a presença do córion até às 48 hpf dificulta a administração dos compostos. Não possui alguns órgãos comparativamente ao Homem como pulmões, membros, septo cardíaco, articulações, osso esponjoso, entre outros42. Além disso, pode ocorrer a duplicação do genoma, ou seja, muitos genes apresentam duas cópias sendo mais difícil determinar papéis funcionais2.
Biologia do peixe-zebra
D. rerio14 é um peixe teleósteo tropical de água doce pertence à família Cyprinidae e é originário do Sul da Ásia. Esta espécie foi proposta como organismo modelo em 1983 por George Streisinger, principalmente para a realização de estudos genéticos e de desenvolvimento embrionário47.
Apresenta um corpo fusiforme, boca superior e uma cabeça curta, variando o seu comprimento total entre 4 a 5 cm3. Tem 5 riscas horizontais azul-escuras e/ou prateadas que se estendem até à barbatana caudal, estando também presentes na barbatana anal. A sua coloração pode ser alterada como uma forma de proteção contra os predadores, como resposta a estímulos visuais ou em situações de stresse44.
Este peixe teleósteo é poiquilotérmico, preferindo temperaturas entre os 26 e os 28 oC, valores ótimos para a sua manutenção e reprodução no biotério. Apresenta um padrão de atividade circadiano semelhante aos mamíferos, estando ativo durante o dia. No seu habitat natural, alimenta-se essencialmente de fitoplâncton, zooplâncton e invertebrados22 e no biotério é alimentado com granulado ou flocos em função da idade podendo ser administrado alimento vivo como os náuplios de artémia (Artemia salina).
Reprodução e ciclo de vida
O peixe-zebra possui um ciclo de vida relativamente curto (atinge a maturidade sexual entre os 3 e os 6 meses de vida no biotério), assíncrono e a reprodução ocorre durante todo o ano34 o que permite a obtenção de ovos em qualquer época. Os ovos são semitransparentes (e não aderentes), o que permite estudar facilmente o rápido desenvolvimento embrionário (usando apenas uma lupa) que dura cerca de 3-4 dpf, dependendo da temperatura da água. É um peixe gregário, ou seja, vive em cardume com 5 a 20 peixes na natureza, o que lhe confere proteção contra predadores e facilita a reprodução31. No biotério esta espécie é mantida em cardumes (enriquecimento ambiental) e tem sido utilizada para estudos de neurocomportamento, aprendizagem, memória, ansiedade/stress mas possibilita também estudar diversas doenças que afetam o homem como os cancros46.
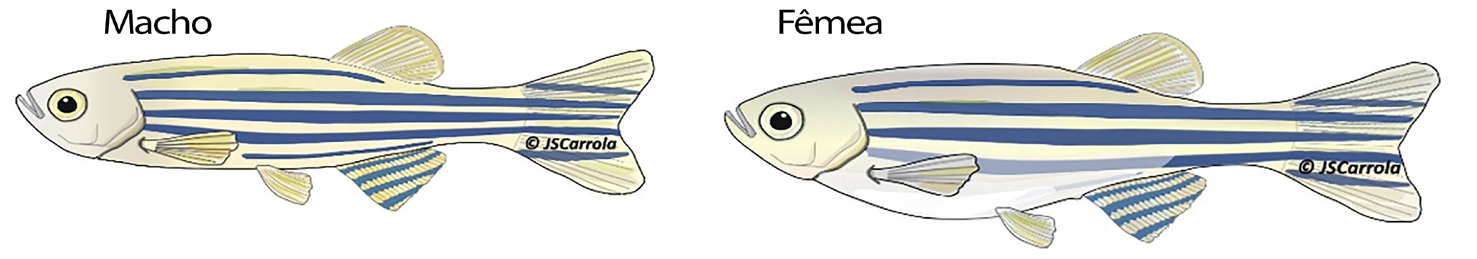
O dimorfismo sexual é visível após a maturidade sexual e existem 3 características externas distintas (FIGURA 3): as fêmeas apresentam um abdómen mais proeminente porque os ovários são maiores que os testículos; os machos em geral produzem mais pigmentos amarelos que as fêmeas (xantóforos), mais visível na barbatana anal e caudal; e presença de uma papila genital (libertação de gametas) junto da barbatana anal é ligeiramente saliente nas fêmeas18, 40.
Às primeiras horas do dia e durante o acasalamento, a postura por parte das fêmeas é coordenada com a libertação de esperma, pelos machos, resultando numa rápida fertilização dos ovos que depois tendem a depositar no fundo.
Em laboratório, a reprodução pode ser melhorada recorrendo ao enriquecimento ambiental, e normalmente são colocadas plantas de plástico e berlindes no fundo das caixas de plástico usadas para recolher os ovos fertilizados.
Existem diversas estratégias de reprodução de peixe-zebra em laboratório, sendo as seguintes as mais comuns (A) e B)):
A) Os machos e fêmeas vivem em aquários separados, e quando se quer induzir a reprodução são colocados juntos num mesmo aquário (FIGURA 4). Os reprodutores podem ser colocados juntos ao final dia e a postura ocorre de manhã cedo, às primeiras horas do dia, ou então os reprodutores são colocados juntos ao início da manhã em que se pretende que ocorra a postura, e esta ocorre durante a manhã. Em ambas situações são colocadas caixas de plástico com fundo duplo nos aquários onde se vão juntar os reprodutores. Isto é, a caixa possui um fundo de rede (removível) cujo diâmetro permite deixar passar os ovos, mas impede que os reprodutores os possam comer. Os ovos depositam- se no fundo da caixa o que facilita a recolha de todos os ovos e os reprodutores regressam aos seus aquários.
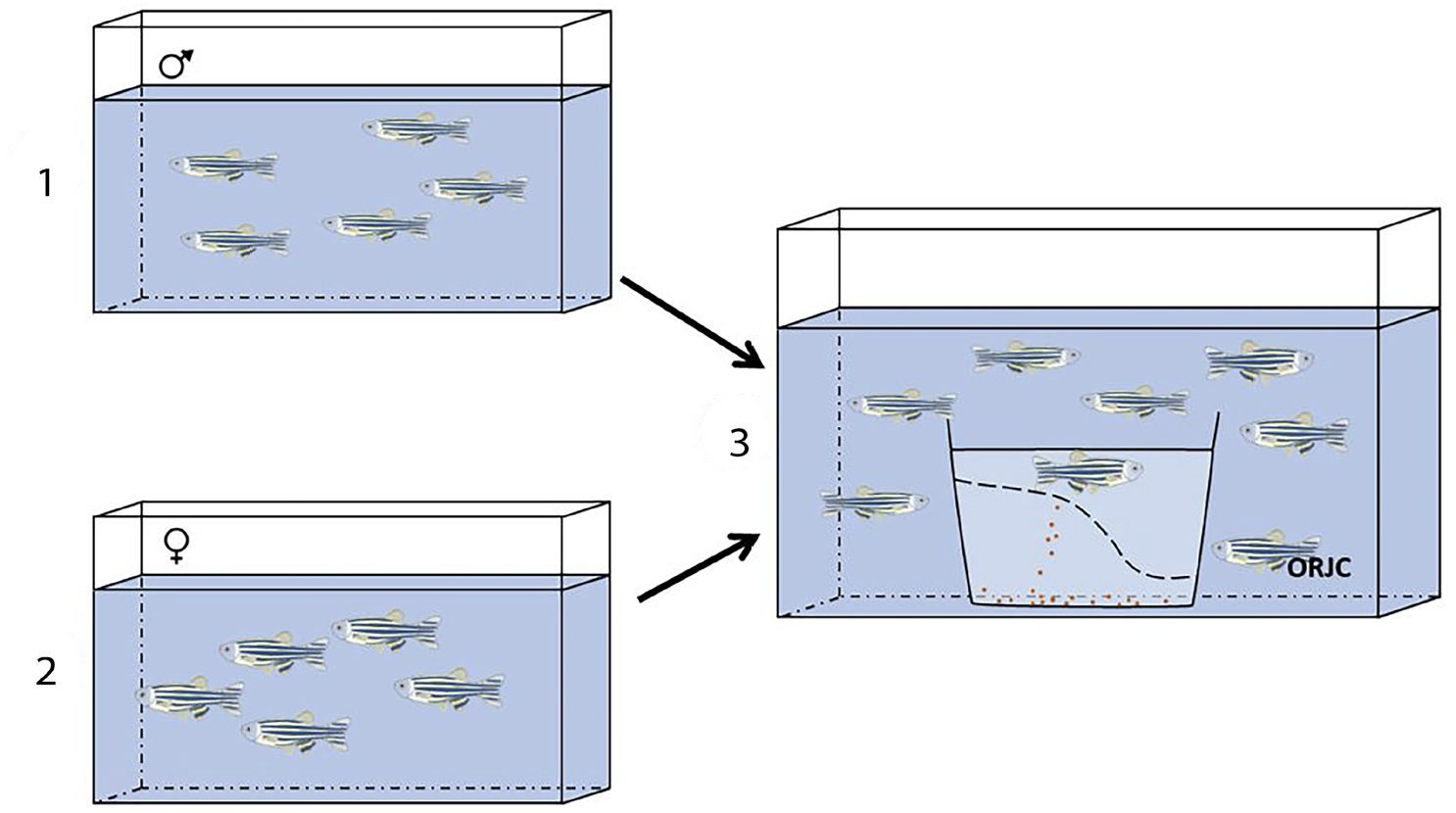
B) Outra técnica de reprodução consiste em ter os peixes macho e fêmea sempre no mesmo aquário, e não é necessário transferir os reprodutores, o que reduz o stresse. Quando é necessário induzir a reprodução é apenas necessário diminuir o nível da água e inserir a caixa de plástico com fundo duplo. Os ovos quando afundam ficam retidos na caixa inferior (FIGURA 5) para facilitar a recolha e evitar que sejam comidos.
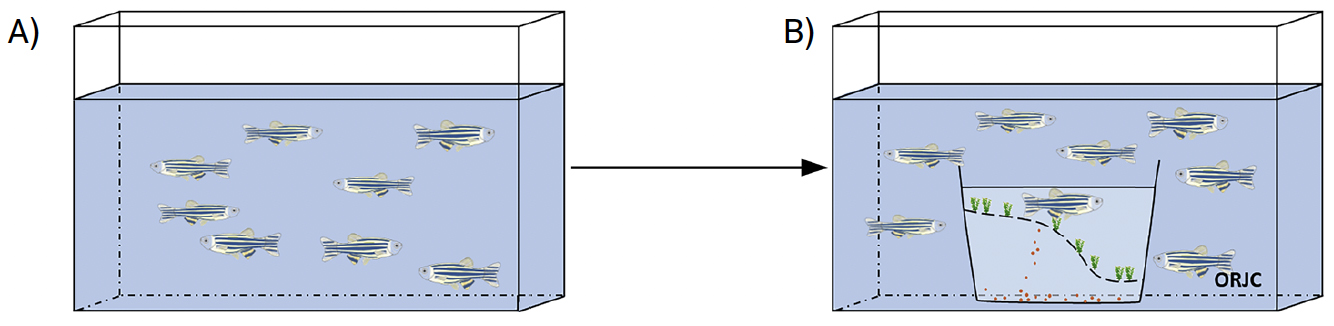
Os ovos de peixe-zebra medem cerca de 0,6-0,7 mm de diâmetro e uma fêmea pode produzir até 700 por postura45. Dependendo das condições ambientais, principalmente da temperatura e fotoperíodo, a eclosão dos ovos ocorre por volta do 2 dpf para a maioria dos ovos, sendo que ao 3 dpf (FIGURA 6) a eclosão é finalizada34.
Desenvolvimento embrionário
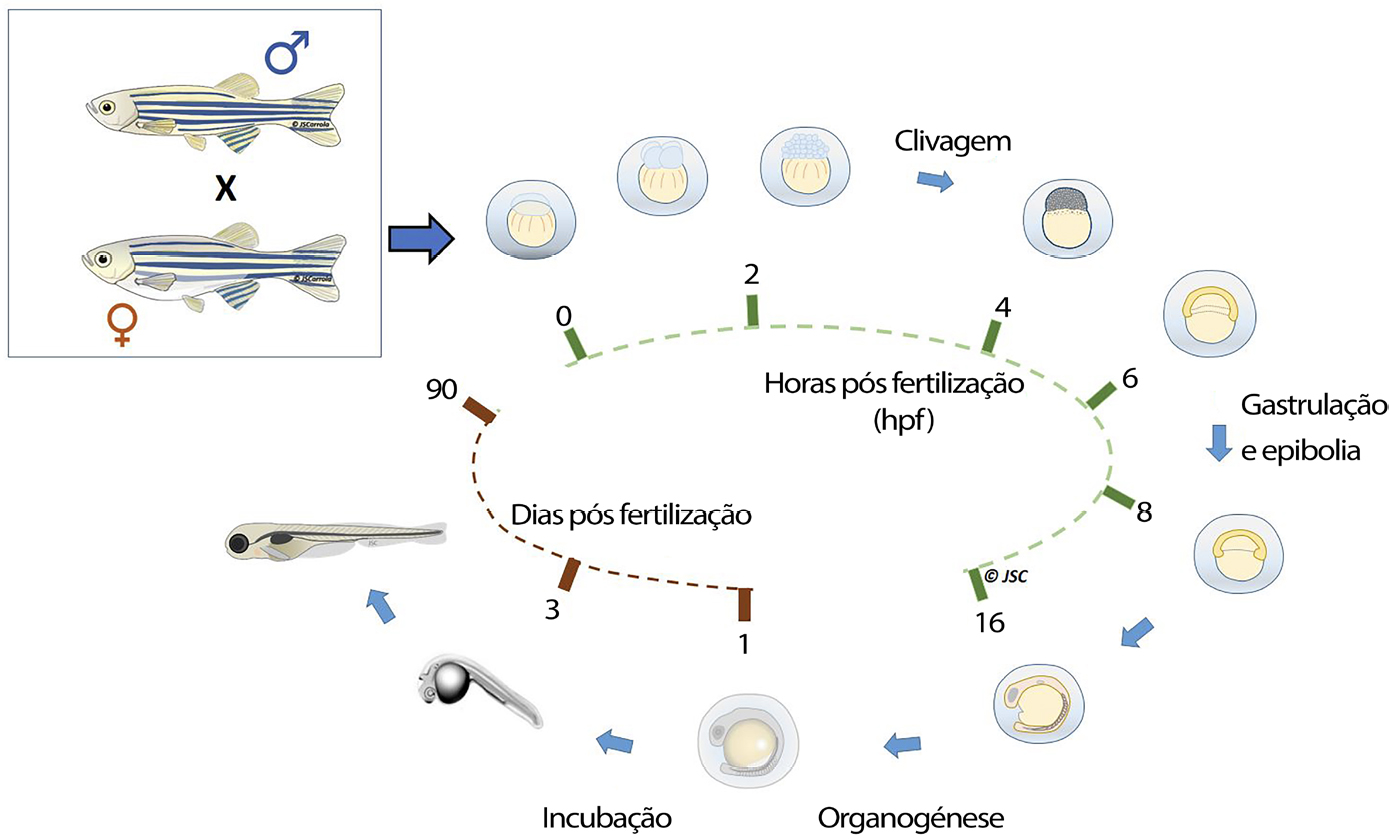
O desenvolvimento embrionário do peixe-zebra começa com a formação do zigoto. O ovo permanece nesta fase até 0,75 horas pós fertilização (hpf), momento em que ocorre a primeira clivagem, que caracteriza o início do período de clivagem. Durante este período (0,75 às 2,25 hpf), ocorrem seis clivagens com intervalos de cerca de 15 minutos, e o organismo vai aumentando o seu grau de celularização (2, 4, 8, 16, 32 e 64 células ou blastómeros). A partir da fase de 128 blastómeros, o organismo entra no período de blástula, durante o qual se forma a camada sincicial do vitelo e tem início a epibolia, que se estende até à gastrulação (5,25 hpf).
No período de gástrula a epibolia continua, e ocorrem movimentos morfogenéticos das células, que conduzem à formação das camadas germinativas primárias e do eixo embrionário. Posteriormente, durante o período de segmentação, ocorre a diferenciação morfológica das primeiras células e os primeiros movimentos do corpo. Durante este período também se observa o aparecimento dos esboços primários dos órgãos e o desenvolvimento de sómitos. Após a formação de 26 pares de sómitos (22 hpf), termina o período de segmentação e começa o de faríngula, que se caracteriza pelo aparecimento de uma notocorda bem desenvolvida, dos arcos faríngicos e das barbatanas peitorais, pelo desenvolvimento do cérebro em 5 lobos distintos, circulação de sangue pelo corpo, entre outos. Este período estende-se até às 42 hpf.
Ulteriormente (72 hpf), ocorre a eclosão, durante o qual o embrião se liberta do córion, dando início ao período larvar, no qual o peixe-zebra passa 4 semanas. Durante esta fase, parâmetros como a temperatura, densidade e diferenças individuais, interferem com o desenvolvimento, tornando-se mais difícil a padronização dos estágios larvares17.
A diferenciação do aparelho reprodutor ocorre mais tarde. Sendo esta uma espécie gonocórica indiferenciada, as gónadas de todos os indivíduos, na fase inicial de maturação, desenvolvem-se como ovários e, só 5 a 7 semanas após a eclosão começa a diferenciação dos testículos em 50% dos indivíduos.
Considerações finais
Apesar de algumas limitações, existem numerosas vantagens associadas à utilização do peixe-zebra (embriões e também animais adultos) como organismo modelo na avaliação ecotoxicológica e também nas ciências biomédicas, para deteção de tóxicos na água, investigação dos mecanismos de ação e efeitos em vários níveis biológicos) o que tem contribuído de forma significativa para o interesse desta espécie bem patente no aumento do número de publicações científicas internacionais.
Por outro lado, o desenvolvimento de linhas transgénicas de peixe-zebra (por exemplo proteínas fluorescentes) permite melhorar o sistema biológico, sendo uma ferramenta ainda mais eficiente para os estudos de ecotoxicologia.
O embrião de peixe-zebra oferece amplas opções para o uso como um organismo complexo e substitui o uso de outros modelos animais como roedores, implementando o princípio dos 3R’s e permite estimar o efeito de tóxicos para as espécies piscícolas nativas e até extrapolar com muita cautela para outros vertebrados incluindo para os humanos quando os mecanismos moleculares ou bioquímicos envolvidos estão bem conservados.
Os poluentes emergentes, como compostos sintéticos industriais, pesticidas, produtos farmacêuticos, medicamentos veterinários e humanos, plásticos, retardantes da chama, substâncias psicoativas, cosméticos etc., são constantemente lançados nos ecossistemas aquáticos e podem afetar a saúde dos animais selvagens, contaminar a água e os peixes, o que pode afetar a saúde humana. É por isso importante monitorizar de forma eficiente, sensível e económica estes compostos tóxicos e sempre que possível implementar medidas legais para reduzir a sua produção e/ou entrada no ambiente para evitar a contaminação da água (limitando os seus usos), dos solos, mas também das cadeias alimentares fundamentais também para a qualidade de vida e saúde do Homem.
Referências
- 1 AICH, A. et al., Ecotoxicological assessment of tannery effluent using guppy fish (Poecilia reticulata) as an experimental model: a biomarker study, Journal of Toxicology and Environmental Health, 78, 278-286. 2015.
- 2 ALI, S. et al., Zebrafish embryos and larvae: a new generation of disease models and drug screens, Birth Defects Research Part C: Embryo Today: Reviews, 93, 115-133. 2011.
- 3 ARUNACHALAM, M. et al., Natural history of zebrafish (Danio rerio) in India, Zebrafish, 10, 1-14. 2013.
- 4 BRUDLER, S. et al., Pollution levels of stormwater discharges and resulting environmental impacts, Science of the total environment, 663, 754-763. 2019.
- 5 CARROLA, J. et al., Frequency of micronuclei and of other nuclear abnormalities in erythrocytes of the grey mullet from the Mondego, Douro and Ave estuaries—Portugal, Environmental Science and Pollution Research, 21, 6057-6068. 2014.
- 6 CARROLA, J. S. et al., Uncommon hepatic macrophagic foamy?cell nodules in Iberian barbel (Lucio barbus bocagei Steindachner, 1864) from the Vizela River (Portugal), Microscopy research and technique, 82, 1127-1135. 2019.
- 7 D’AMORA, M. & GIORDANI, S., The utility of zebrafish as a model for screening developmental neurotoxicity, Frontiers in neuroscience, 12, 976. 2018.
- 8 DOKE, S. K. & DHAWALE, S. C., Alternatives to animal testing: A review, Saudi Pharmaceutical Journal, 23, 223-229. 2015.
- 9 DUTRA COSTA, B. P. et al., Zebrafish Models in Neural and Behavioral Toxicology across the Life Stages, Fishes, 5, 23. 2020.
- 10 FÉLIX, L. M. et al., Ketamine induction of p53-dependent apoptosis and oxidative stress in zebrafish (Danio rerio) embryos, Chemosphere, 201, 730-739. 2018.
- 11 FIGUEIREDO-FERNANDES, A. et al., Histopathological changes in liver and gill epithelium of Nile tilapia, Oreochromis niloticus, exposed to waterborne copper, Pesquisa Veterinária Brasileira, 27, 103-109. 2007.
- 12 GAUTHIER, P. T. & VIJAYAN, M. M., Nonlinear mixed-modelling discriminates the effect of chemicals and their mixtures on zebrafish behavior, Scientific reports, 8, 1-11. 2018.
- 13 GOMES, A. R. et al., Review of the ecotoxicological effects of emerging contaminants to soil biota, Journal of Environmental Science and Health, 52, 992-1007. 2017.
- 14 HAMILTON, F., An account of the fishes found in the river Ganges and its branches, Archibald Constable and Company. 1822.
- 15 HOWE, K. et al., The zebrafish reference genome sequence and its relationship to the human genome, Nature, 496, 498. 2013.
- 16 HUANG, H. et al., Bioaccumulation and biomagnification of short and medium chain polychlorinated paraffins in different species of fish from Liaodong Bay, North China, Scientific reports, 1-9. 2017.
- 17 KIMMEL, C. B. et al., Stages of embryonic development of the zebrafish, Developmental dynamics, 203, 253-310. 1995.
- 18 KOSSACK, M. E. & DRAPER, B. W., Genetic regulation of sex determination and maintenance in zebrafish (Danio rerio), Current topics in developmental biology, 134, 119-149. 2019.
- 19 LAMMER, E. et al., Is the fish embryo toxicity test (FET) with the zebrafish (Danio rerio) a potential alternative for the fish acute toxicity test?, Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 149, 196-209. 2009.
- 20 LAVOIE, R. A. et al., Biomagnification of mercury in aquatic food webs: a worldwide meta-analysis, Environmental science & technology, 47, 13385-13394. 2013.
- 21 LAWRENCE, C., The husbandry of zebrafish (Danio rerio): a review, Aquaculture, 269, 1-4, 1-20. 2007.
- 22 MCCLURE, M. et al., Notes on the natural diet and habitat of eight danionin fishes, including the zebrafish Danio rerio, Journal of Fish Biology, 69, 553-570. 2006.
- 23 NASSOUR, C. et al., Aquatic ecotoxicology of anticancer drugs: A systematic review, Science of the total environment, 800, 149598. 2021.
- 24 NORRGREN, L., Fish models for ecotoxicology, Acta Veterinaria Scandinavica, 54, 14. 2012.
- 25 OECD, Early-Life Stage Toxicity Test, OECD Publishing, Paris. 1992.
- 26 OECD, Test No. 212: Fish, Short-term Toxicity Test on Embryo and Sac-Fry Stages, OECD Guidelines for the Testing of Chemicals, Paris. 1998.
- 27 OECD, Test No. 215: Fish, Juvenile Growth Test, OECD Guidelines for the Testing of Chemicals, Paris. 2000.
- 28 OECD, Test No. 95: Detailed Review Paper on Fish Life-Cycle Tests, OECD Publishing, Paris. 2008.
- 29 OECD, Test No. 203: Fish, Acute Toxicity Test, OECD Guidelines for the Testing of Chemicals, OECD Publishing, Paris. 2019.
- 30 ORIAS, F. & PERRODIN, Y., Characterisation of the ecotoxicity of hospital effluents: a review, Science of the total environment, 454, 250-276. 2013.
- 31 PARICHY, D. M., The natural history of model organisms: Advancing biology through a deeper understanding of zebrafish ecology and evolution, Elife 4, e05635. 2015.
- 32 PÉREZ-PEREIRA, A. et al., Ketamine and norketamine: enantioresolution and enantioselective aquatic ecotoxicity studies, Environmental toxicology and chemistry, 1-11. 2020.
- 33 PINTO, M. Q. et al., Effect of copper sulphate in the behavior of Mozambique tilapia under different temperatures, Fishes in Mediterranean Environments, 3. 2018.
- 34 RIBAS, L. & PIFERRER, F., The zebrafish (Danio rerio) as a model organism, with emphasis on applications for finfish aquaculture research, Reviews in Aquaculture, 6, 209-240. 2014.
- 35 RIBEIRO, O. et al., Effects of venlafaxine on zebrafish larvaebehaviour - preliminary results. Poster presented in VIII Congresso da Sociedade Ibérica de Ictiologia, Santiago de Compostela, 76. ISSN: 2659-8760. 2020.
- 36 RIBEIRO, O. et al., Contaminação do solo com fármacos e efeitos nasminhocas, Poster presented in Congresso Ibérico “Solo e Desenvolvimento Sustentável: Desafios e Soluções”. 2021.
- 37 RIBEIRO, O. et al., Genotoxicity assessment using comet assay in mozambique tilapia under the effect of copper and temperature - preliminary data, Poster presented in VIIICongresso da Sociedade Ibérica de Ictiologia, Santiago de Compostela, 77, ISSN: 2659-8760. 2020.
- 38 RIBEIRO, O. M. et al., A dáfnia como sensor da ecotoxidade, Revista de Ciência Elementar, 9, 044. 2021.
- 39 ROMANO, S. et al., Ecotoxicity, genotoxicity, and oxidative potential tests of atmospheric PM10 particles, Atmospheric Environment, 117085. 2019.
- 40 RUHL, N. et al., Shoaling preferences and the effects of sex ratio on spawning and aggression in small laboratory populations of zebrafish (Danio rerio), Lab animal, 38, 264. 2009.
- 41 RUSSELL, W. M. S. & BURCH, R. L., The principles of humane experimental technique, Methuen, London. 1959.
- 42 SANTOS, D. et al., Zebrafish early life stages for toxicological screening: insights from molecular and biochemical markers, Advances in Molecular Toxicology, 12, 151-179. 2018.
- 43 SHEN, C. & ZUO, Z., Zebrafish (Danio rerio) as an excellent vertebrate model for the development, reproductive, cardiovascular, and neural and ocular development toxicity study of hazardous chemicals, Environmental Science and Pollution Research, 1-16. 2020.
- 44 SPENCE, R. et al., The distribution and habitat preferences of the zebrafish in Bangladesh, Journal of Fish Biology, 69, 1435-1448. 2006.
- 45 SPENCE, R. et al., The behaviour and ecology of the zebrafish, Danio rerio, Biological reviews, 83, 13-34. 2008.
- 46 STOLETOV, K. & KLEMKE, R., Catch of the day: zebrafish as a human cancer model, Oncogene, 27, 4509-4520. 2008.
- 47 STREISINGER, G. et al., Segregation analyses and gene-centromere distances in zebrafish, Genetics, 112, 311-319. 2008.
- 48 VAN DER OOST, R. et al., Fish bioaccumulation and biomarkers in environmental risk assessment: a review, Environmental toxicology and pharmacology, 13, 57-149. 2003.
- 49 VIEIRA, R. et al., Toxic effects of a mancozeb-containing commercial formulation at environmental relevant concentrations on zebrafish embryonic development, Environmental Science and Pollution Research, 27, 21174-21187. 2020.
- 50 VO, H. C. & PHAM, M. H., Ecotoxicological effects of microplastics on aquatic organisms: a review, Environmental Science and Pollution Research, 28, 44716-44725. 2021.
- 51 WHITE, R. et al., Zebrafish cancer: the state of the art and the path forward, Nature reviews Cancer, 13, 624. 2013.
Este artigo já foi visualizado 13379 vezes.



