Etileno
📧 , 📧 , 📧
- * CEF/ LAT/ DCV/ U. Coimbra
- ɫ CEF/ LAT/ DCV/ U. Coimbra
- ‡ CEF/ LAT/ DCV/ U. Coimbra
Referência Neves, M., Correia, S., Canhoto, J., (2024) Etileno, Rev. Ciência Elem., V12(2):013
DOI http://doi.org/10.24927/rce2024.013
Palavras-chave desenvolvimento vegetal, hormonas, plantas, stress biótico e abiótico
Resumo
O etileno, C2H4, é uma hormona vegetal que tem um papel crucial em vários processos do desenvolvimento das plantas e em repostas a vários fatores de stresse. O seu efeito nos tecidos vegetais é consequência de uma via de sinalização complexa que envolve a ativação de fatores de transcrição que controlam a expressão de inúmeros genes de resposta ao etileno. Esta hormona tem um papel fundamental no desenvolvimento da raiz, formação de pelos radiculares, senescência, abcisão foliar e maturação dos frutos. O etileno está também envolvido na tolerância a diversos fatores de stresses abióticos e bióticos como temperaturas elevadas, salinidade, seca e ataques de fungos e bactérias. De um modo geral, esta hormona destaca-se como um elemento-chave na regulação de processos de desenvolvimento, stresse e adaptação das plantas ao ambiente que as rodeia.
O etileno é uma hormona vegetal de estrutura simples, C2H4, gasosa à temperatura ambiente, que é sintetizada e libertada pelos tecidos vegetais1. Apesar da sua simplicidade, participa em múltiplos processos do desenvolvimento vegetal e em várias respostas aos stresses bióticos e abióticos2. O efeito do etileno nas plantas foi reportado pela primeira vez na ervilha, em 1901, por Dimitry Neljubov. No entanto, foi Richard Gane, em 1934, quem fez a grande descoberta de que as plantas não só respondiam ao etileno, como também o sintetizavam3. A correlação entre a síntese de etileno e a sua atividade biológica mostrou à comunidade científica que moléculas em estado gasoso podiam atuar também como hormonas4. O etileno marcou, assim, a história como a primeira molécula gasosa com função sinalizadora a ser conhecida.
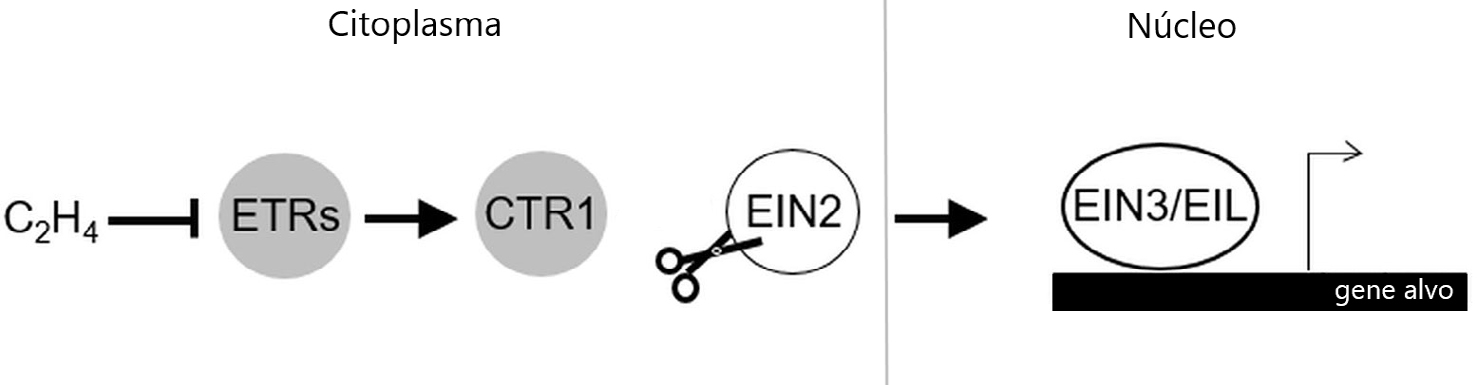
A biossíntese do etileno foi bastante estudada na segunda metade do século XX, período no qual Adams e Yang identificaram a s-adenosilmetionina (SAM) e o ácido aminociclopropano carboxílico (ACC), como os seus dois intermediários5, 6. De um modo geral, a biossíntese desta hormona inicia-se com a conversão de SAM em ACC, pela ACC sintase, e finalmente o ACC é convertido em etileno pela ACC oxidase7. O uso de diversos mutantes com resposta variável ao etileno, obtidos da planta modelo Arabidopsis thaliana, permitiu ao longo dos anos não só compreender a função desta hormona no desenvolvimento vegetal, como também perceber quais os componentes da sua via de sinalização8, dos quais se destacam os recetores de etileno. O recetor de etileno denominado Ethylene Receptor 1 (ETR1) em A. thaliana foi não só o primeiro recetor de etileno identificado, como também foi o primeiro recetor de hormonas vegetais a ser clonado e sequenciado9. Em A. thaliana, o etileno é reconhecido por uma família de cinco recetores denominados ETR1, ERS1 (Ethylene Response Sensor 1), ETR2, EIN4 (Ethylene Insensitive 4) e ERS210. Estes recetores situam-se na membrana do retículo endoplasmático (ER) e é a partir da ligação do etileno ao recetor que se desencadeia uma via de sinalização complexa11. Dois componentes chave nesta via de sinalização são a proteína-cinase Constituve Triple Response 1 (CTR1) e a proteína Ethylene Insensitive 2 (EIN2), que funcionam como reguladores negativos e positivos, respetivamente (FIGURA 1). CTR1 tem a função de fosforilar EIN2 e impedir a sua função na via de sinalização; já EIN2 quando não impedida tem a função de aumentar a atividade de fatores de transcrição EIN3 e EIN3-LIKE 1 (EIL1) que, por sua vez, controlam a transcrição de genes de resposta ao etileno, como os fatores de transcrição da família ERFs (Ethylene Response Factors).
De uma maneira geral, na ausência de etileno (ar) os recetores mantêm a proteína-cinase CTR1 ativa, que por sua vez fosforila EIN2. Esta fosforilação diminui os níveis de EIN2 impedindo o seu transporte para o núcleo e a ativação dos fatores de transcrição. Na presença de etileno, a sua ligação inibe os recetores, com consequente desactivação de CTR1. A perda de atividade de CTR1 permite a clivagem da proteína não fosforilada EIN2, ancorada no ER. O domínio C-terminal de EIN2 (EIN2-C) libertado após a clivagem, é transportado para o núcleo e ativa a via de sinalização a jusante de EIN2 ao desencadear a atividade dos fatores de transcrição EIN3/EIL111, 12.
As diferentes respostas ao etileno revelam os inúmeros papéis em que esta hormona está envolvida, quer ao nível do desenvolvimento vegetal, quer nas respostas a vários fatores de stress (FIGURA 2). Convém lembrar que o papel do etileno é muitas vezes resultado de uma interação com outras hormonas vegetais, como as auxinas, as citocininas, as giberelinas e o ácido abscísico (ABA)13. O efeito do etileno nas plantas começa mesmo antes da germinação e tem um papel essencial no desenvolvimento da plântula14. A germinação das sementes envolve inicialmente uma quebra da dormência, que resulta de um equilíbrio hormonal entre o ABA e as giberelinas15. De um modo geral, o ABA mantém o fenómeno de dormência, enquanto as giberelinas quebram este efeito e promovem a germinação15. O etileno participa no processo de quebra da dormência, pois promove a germinação por diminuir os efeitos do ABA através da regulação do seu metabolismo e via de sinalização16. O etileno está também envolvido no crescimento do hipocótilo, porém o seu efeito depende da presença ou ausência de luz, observando- se o crescimento dos hipocótilos à luz, enquanto o seu alongamento é inibido no escuro14, 17. Ao nível do sistema radicular, o etileno tem um papel inibitório tanto no desenvolvimento da raiz principal, como das raízes laterais18. As auxinas e o etileno inibem sinergesticamente o desenvolvimento da raiz principal, no entanto, as auxinas são essenciais para a formação de raízes laterais19. O efeito inibitório do etileno no desenvolvimento radicular é inerente à sua regulação na biossíntese, transporte e acumulação de auxinas nas diferentes zonas da raiz18, 20. Resumidamente, o etileno leva a uma acumulação de auxinas tanto na zona meristemática como na zona de alongamento da raiz, resultando na inibição da proliferação e do alongamento celular18. Esta acumulação de auxinas no ápice da raiz impede que estas se acumulem nas zonas laterais18, 19, onde seriam necessárias para a formação de raízes laterais. No entanto, o etileno promove a formação de pelos radiculares, pela ativação de fatores de transcrição envolvidos na sua iniciação e desenvolvimento21.
O etileno é também uma hormona chave no processo de envelhecimento das plantas estando envolvido no amadurecimento dos frutos e na senescência e abcisão das folhas e das flores13. Ao nível da folha, este fenómeno está, em grande parte, relacionado com a perda de clorofila22, 23; já ao nível das flores, o etileno desencadeia um conjunto de eventos celulares nos seus diferentes órgãos, que levam à sua senescência e posterior abcisão13, 24. O amadurecimento dos frutos climatéricos é o papel mais reconhecido do etileno, pois tem importantes aplicações económicas25. Os frutos climatéricos são todos aqueles que apresentam uma taxa de respiração elevada durante o seu amadurecimento, acompanhada de uma grande produção de etileno, tais como a maçã, banana, tomate, entre ouros26. O aumento na síntese de etileno e da sua perceção leva à ativação de fatores de transcrição da família ERF, que, de seguida, modulam a transcrição de genes de resposta ao etileno, neste caso, genes associados ao amadurecimento27. Este processo leva a alteações fisiológicas e bioquímicas no fruto como a redução dos níveis de clorofila e o aumento de antocianinas, modificações no metabolismo dos açúcares e na biossíntese de compostos orgânicos voláteis, que resultam na mudança de cor, amolecimento e aumento do aroma, sabor e conteúdo em açúcares13, 25. Controlar o processo de amadurecimento dos frutos pós-colheita é fundamental para aumentar o seu tempo de prateleira13. A estratégia mais comum passa por reduzir a síntese ou ação do etileno nos tecidos vegetais; por exemplo, o composto 1-metilciclopropeno (1-MCP) tem sido usado ao longo dos anos para reduzir a ação do etileno, pois atua como um inibidor competitivo para os recetores de etileno28. Diminuir a temperatura e controlar a atmosfera de armazenamento a que os frutos estão expostos também é uma das estratégias utilizadas, já que a redução dos níveis de O2 e o aumento de CO2 diminui a respiração e a sensibilidade ao etileno29.
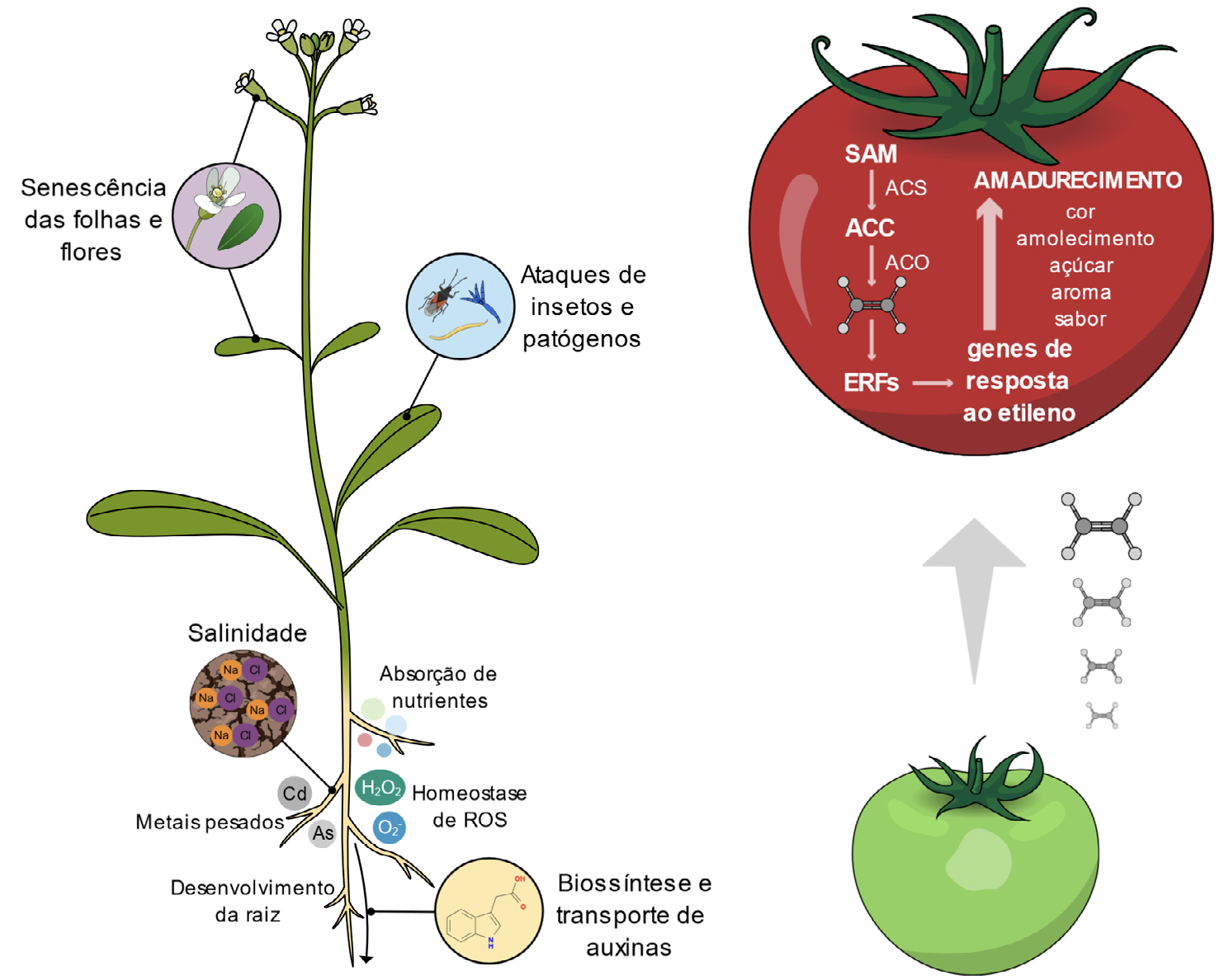
Nos últimos anos vários estudos têm reportado o papel do etileno na tolerância a vários fatores
de stresse, como calor30, hipóxia31, metais pesados32, salinidade33, seca34, e ataque de bactérias,
fungos e herbívoros35, 36. No entanto, é de referir que, dependendo da espécie, o etileno
pode também ter uma pepel negativo nestas respostas e tornar a planta mais suscetível37. A
tolerância a temperaturas mais elevadas promovida pelo etileno está relacionada com a homeostase
de espécies reativas de oxigénio (ROS), regulada por antioxidantes enzimáticos e
não-enzimáticos resultando em menores danos oxidativos30. Em condições baixas de O
Numa altura em que as preocupações relacionadas às alterações climáticas e à segurança alimentar estão em destaque, o etileno revela-se como uma hormona chave na regulação da capacidade adaptativa das plantas. Assim, é essencial compreender os múltiplos papéis do etileno e os seus mecanismos de sinalização para encontrar novas estratégias que otimizem o desenvolvimento das plantas e a sua adaptação a ambientes pouco favoráveis.
Materiais relacionados disponíveis na Casa das Ciências:
- Ação do Etileno na maturação dos frutos, porque é que os frutos ficam mais maduros se deixados ao ar?
Referências
- 1 ABELES, F. B., Ethylene in Plant Biology, New York, USA: Academic Press. 1973.
- 2 KHAN, N. A. et al., Editorial: Ethylene: A Key Regulatory Molecule in Plants, Front Plant Sci, 8, 1782. 2017.
- 3 BAKSHI, A. et al., History of Research on the Plant Hormone Ethylene, J Plant Growth Regul, 34, 809-827. 2015.
- 4 CHANG, C., Q&A, How do plants respond to ethylene and what is its importance?, BMC Biol, 14, 7. 2016.
- 5 ADAMS, D. O. & YANG S. F., Ethylene biosynthesis: Identification of 1-aminocyclopropane-1-carboxylic acid as an intermediate in the conversion of methionine to ethylene, Proc Natl Acad Sci USA, 76, 170-174. 1979.
- 6 ADAMS, D. O. & YANG S. F., Methionine Metabolism in Apple Tissue: implication of s-adenosylmethionine as an intermediate in the conversion of methionine to ethylene, Plant Physiol, 60, 892-896. 1977.
- 7 YANG, S. F. & HOFFMAN, N. E., Ethylene biosynthesis and its regulation in higher plants, Annu Rev Plant Physiol, 35, 155-189. 1984.
- 8 CHEN, Y. F. et al., Ethylene signal transduction, Ann Bot, 95, 901-915. 2005.
- 9 CHANG, C. et al., Arabidopsis Ethylene-Response Gene ETR1: Similarity of Product to Two-Component Regulators, Science, 262, 539- 544. 1993.
- 10 BLEECKER, A. B. et al., The ethylene-receptor family from Arabidopsis: structure and function, Philos Trans R Soc Lond B Biol Sci, 353, 1405-1412. 1998.
- 11 BINDER, B. M., Ethylene signaling in plants, J Biol.Chem, 295, 7710-7725. 2020.
- 12 DOLGIKH, V. A. et al., Shaping Ethylene Response: The Role of EIN3/EIL1 Transcription Factors, Front Plant Sci, 10, 1030. 2019.
- 13 IQBAL, N. et al., Ethylene Role in Plant Growth, Development and Senescence: Interaction with Other Phytohormones, Front Plant Sci, 8, 475. 2017.
- 14 AHAMMED, G. J. et al., Role of ethylene crosstalk in seed germination and early seedling development: A review, Plant Physiol Biochem, 151, 124-131. 2020.
- 15 FINCH-SAVAGE, W. E. & LEUBNER-METZGER, G., Seed dormancy and the control of germination, New Phytol, 171, 501-523. 2006.
- 16 CORBINEAU, F. et al., Ethylene, a key factor in the regulation of seed dormancy, Front Plant Sci, 5, 539. 2014.
- 17 ZHONG, S. et al., A molecular framework of light-controlled phytohormone action in Arabidopsis, Curr Biol, 22, 1530-1535. 2012.
- 18 QIN, H. & HUANG, R., Auxin Controlled by Ethylene Steers Root Development, Int J Mol Sci, 19, 3656. 2018.
- 19 MUDAY, G. K. et al., Auxin and ethylene: collaborators or competitors?, Trends Plant Sci, 17, 181-195. 2012.
- 20 R?ZICKA, K. et al., Ethylene regulates root growth through effects on auxin biosynthesis and transport-dependent auxin distribution, Plant Cell, 19, 2197-2212. 2007.
- 21 FENG, Y. et al., Ethylene promotes root hair growth through coordinated EIN3/EIL1 and RHD6/RSL1 activity in Arabidopsis, Proc Natl Acad Sci USA, 114, 13834-13839. 2017.
- 22 GEPSTEIN, S. & THIMANN, K. V., The Role of Ethylene in the Senescence of Oat Leaves, Plant Physiol, 68, 349-354. 1981.
- 23 KOUKOUNARAS, A. et al., 1-Methylcyclopropene prevents ethylene induced yellowing of rocket leaves, Postharvest Biol and Technol, 41, 109-111. 2006.
- 24 WOLTERING, E. J. & VAN DOORN, W. G., Role of Ethylene in Senescence of Petals—Morphological and Taxonomical Relationships, J Exp Bot, 39, 1605–1616. 1988.
- 25 KOU, X. et al., Different regulatory mechanisms of plant hormones in the ripening of climacteric and non-climacteric fruits: a review, Plant Mol Biol, 107, 477-497. 2021.
- 26 KOU, X. & WU, M., Characterization of Climacteric and Non-Climacteric Fruit Ripening, Methods Mol Biol, 1744, 89-102. 2018.
- 27 LIU, M. et al., Ethylene Control of Fruit Ripening: Revisiting the Complex Network of Transcriptional Regulation, Plant Physiol, 169, 2380- 2390. 2015.
- 28 BLANKENSHIP, S. M. & DOLE, J. M., 1-Methylcyclopropene: a review, Postharvest Biol and Technol, 28, 1-25. 2003.
- 29 MAHAJAN, P. V. et al., Postharvest treatments of fresh produce, Philos Trans A Math Phys Eng Sci, 372, 20130309. 2014.
- 30 POÓR, P. et al., Ethylene involvement in the regulation of heat stress tolerance in plants, Plant Cell Rep, 41, 675-698. 2022.
- 31 SHEKHAWAT, K. et al., Ethylene: A Master Regulator of Plant-Microbe Interactions under Abiotic Stresses, Cells, 12, 31. 2022.
- 32 KEUNEN, E. et al., Ethylene and Metal Stress: Small Molecule, Big Impact, Front Plant Sci, 7, 23. 2016.
- 33 RIYAZUDDIN, R. et al., Ethylene: A Master Regulator of Salinity Stress Tolerance in Plants, Biomolecules, 10, 959. 2020.
- 34 CUI, M. et al., Ethylene increases accumulation of compatible solutes and decreases oxidative stress to improve plant tolerance to water stress in Arabidopsis, J Plant Biol, 58, 193-201. 2015.
- 35 LU, J. et al., Contrasting effects of ethylene biosynthesis on induced plant resistance against a chewing and a piercing-sucking herbivore in rice, Mol Plant, 7, 1670-1682. 2014.
- 36 VAN DER ENT, S. & PIETERSE, C. M. J., Ethylene: Multi-Tasker in Plant-Attacker Interactions, Wiley-Blackwell: New Jersey, USA, 44, 343-377. 2012.
- 37 FATMA, M. et al., Ethylene Signaling under Stressful Environments: Analyzing Collaborative Knowledge, Plants, 11, 2211. 2022.
- 38 FU, S. F. et al., Transcriptome profiling of genes and pathways associated with arsenic toxicity and tolerance in Arabidopsis, BMC Plant Biol, 14, 94. 2014.
- 39 CAO, F. et al., Genome-wide transcriptome and functional analysis of two contrasting genotypes reveals key genes for cadmium tolerance in barley, BMC Biol, 15, 611. 2014.
- 40 GUAN, C. et al., The glutathione synthesis may be regulated by cadmium-induced endogenous ethylene in Lycium chinense, and overexpression of an ethylene responsive transcription factor gene enhances tolerance to cadmium stress in tobacco, Molecular Breeding, 35, 123. 2015.
Este artigo já foi visualizado 9017 vezes.



