Cinco factos para refletir sobre a unidade mole
📧 , 📧 , 📧
- * IFCE
- ɫ LOCEM-UFC
- ‡ SEDUC-CE
Referência Vasconcelos, S. J. T., Nascimento, J. P. C., Nascimento, R. G. M., (2024) Cinco factos para refletir sobre a unidade mole, Rev. Ciência Elem., V12(2):018
DOI http://doi.org/10.24927/rce2024.018
Palavras-chave Definição da mole; 2. Constante de Avogadro; 3. Cálculos envolvendo a mole
Resumo
A mole é uma das unidades de medição mais importantes em Química. Por estar intimamente ligado a constante de Avogadro e ser usado para quantificar entidades atómicas e moleculares, a mole não parece aplicar-se ao mundo macroscópico. No entanto, veremos que esta unidade pode ser usada para outros fins no nosso dia a dia, mas devido às suas particularidades os resultados estão, geralmente, fora da nossa escala habitual de entendimento. O texto que se segue é um exercício mental para perceber o quão pequenas são as entidades elementares e quão grande é o número destas presente numa única mole.
A mole contém uma quantidade fixa de entidades da mesma forma que uma dúzia contém sempre doze unidades de qualquer coisa. Esta analogia é amplamente utilizada na sala de aula para familiarizar os alunos com a grandeza quantidade de matéria nos primeiros contactos com este assunto. No entanto, compreender o número de entidades contidas num mole não é tão trivial como contar quantidades numa dúzia. Esta dificuldade está relacionada, entre outros, com o facto de a mole não ser comumente aplicado a objetos ou entidades do nosso dia a dia.
A mole é uma unidade específica para partículas de escala atómica e molecular, genericamente chamadas entidades elementares. Presente no Sistema Internacional de Unidades (SI) desde 19711, o conceito de mole mudou recentemente e desde 2019 tem uma nova definição. Atualmente, a mole corresponde exatamente a 6,02214076 × 1023 entidades elementares2. Este número imenso é o valor numérico da constante de Avogadro (NA), em unidade de mol-1. Note como mole tanto é o nome da unidade como seu símbolo. Pelas suas características é sempre necessário especificar quais as entidades elementares quantificadas, como átomos, iões, moléculas ou mesmo eletrões.
Do ponto de vista químico, a mole é muito útil porque mantém uma relação direta com a massa e a quantidade de entidades elementares de uma substância. Para as conversões adequadas é necessário conhecer a massa molar (M) da substância e o valor de NA, como se pode ver no diagrama seguinte.
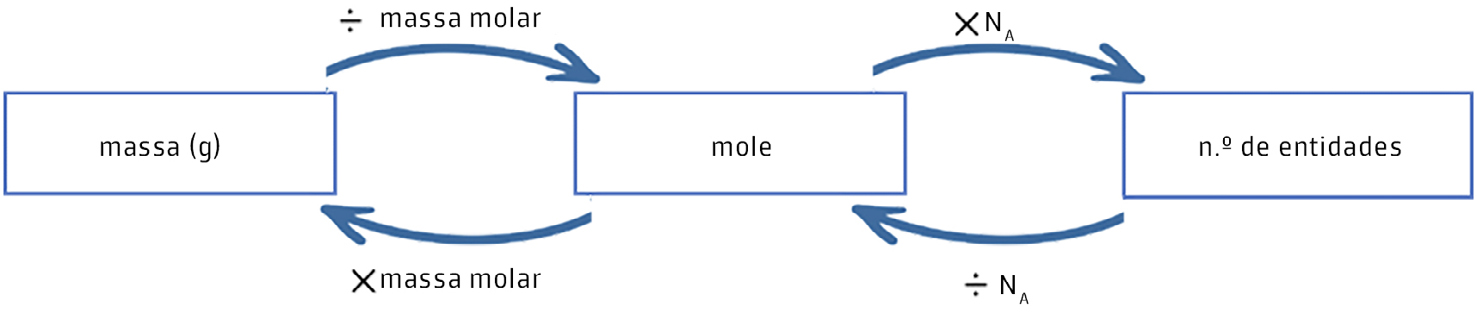
Os químicos tendem a tratar a mole como uma “forma de acesso ao mundo microscópico” que lhes permite quantificar entidades em substâncias e reações. Trata-se de uma importante ferramenta para estes profissionais.
Matematicamente, a quantidade de substância expressa em moles \(\left ( n \right )\) contidos numa massa \(m\) (em gramas) é expresso como:
\(n=\frac{m}{M}\) (1)
Quando \(M\) é a massa molar em g mole-1 (isto é, a massa em gramas que é equivalente a uma mole da substância). Na prática, \(M\) tem o mesmo valor numérico da massa atómica ou molecular para átomos e moléculas, respectivamente.
O número de partículas elementares \(\left ( N \right )\) é expresso como:
\(N=n\times N_a\) (2)
A combinação direta dos (1) e (2) resulta em:
\(N=\frac{m\times N_A}{M}\) (3)
Uma equação que permite calcular diretamente o número de entidades elementares a partir da massa da substância em gramas.
Embora a definição torne claro que as aplicações da mole são para partículas elementares, não existem impedimentos para usar esta unidade para o mundo macroscópico. No entanto, os resultados obtidos fogem da nossa escala habitual e, por vezes, parecem absurdos. Tudo por causa do imenso valor de NA. Neste artigo será demonstrado isso através de cinco factos.
Facto 1.
Há mais moléculas de água em uma colher de sopa do que colheres de água nos oceanos.
Para o cálculo do número de moléculas, adotaremos que o volume \(\left ( V_a \right )\) de uma colher de sopa seja de 15 mL e a densidade \(\left ( d_a \right )\) da água a temperatura ambiente seja de 1,0 g mL-1. Portanto, a massa \(\left ( m_a \right )\) equivalente ao volume mencionado é:
\(m_a=d_a\times V_a\)
\(m_a=1,0gmL^{-1}\times15 mL=15\textrm{g}\) (4)
Para a água (H2O), a massa molar é \(M = 18\)g \(\textrm{mole}^{-1}\), aproximadamente. Assim, substituindo diretamente em (3):
\(N=\frac{15\textrm{g}\times 6,02214076\times 10^{23}\textrm{mole}^{-1}}{18\textrm{g mole}^{-1}}=5,0\times 10^{23}\)
Moléculas de H2O. Note que é desnecessário utilizar todas as casas decimais de NA. De agora em diante, serão utilizadas apenas três delas.
O volume de água nos oceanos pode ser calculado a partir do seu volume total estimados de3 \(1, 34 × 10^9\) km3, algo em torno de \(1,34\times 10^{24}mL\). Portanto, o número de colheres de sopa de água é:
\(\frac{1,34\times 10^{24}mL}{15mL}=8,9\times 10^{22}\)
O resultado mostra como moléculas de água são pequenas e leves, ao ponto de uma única colher de sopa conter um número tão imenso destas.
É importante salientar que, neste caso, ignoramos a presença de sais na água do mar. No entanto, mesmo que incluíssemos os sais presentes na água, o resultado não seria diferente, uma vez que a redução seria proporcional em ambos os cálculos.
Facto 2.
Há menos de uma mole de grãos de areia nas praias da Terra.
Esta demonstração é mais simples, se soubermos quantos grãos de areia há nas praias, logicamente. Felizmente para nós, este valor já foi estimado4 como \(7,5 \times 10^{18}\), ou seja, bem inferior ao valor numérico da constante de Avogadro. Na verdade, precisaríamos de mais de 80 mil planetas terrestres para ter uma mole de grãos de areia nas praias. Este facto evidencia a imensidão do valor de NA que se revela inadequado para uso em partículas aparentemente pequenas (como grãos de areia), mas ainda grandes para a escala atómica e molecular.
Facto 3.
Uma mole de metros é mais do que suficiente para atravessar a Via Láctea.
Outra demonstração simples, desde que saibamos as dimensões de nossa galáxia. Com um diâmetro estimado em 100.000 anos-luz5, o que equivale a cerca \(9,46\times 10^{20}\) metros, a Via Láctea tem um diâmetro em metros inferior ao valor de uma mole (isto é, \(6,022\times 10^{23}\) metros). Só se medíssemos em milímetros o valor numérico do diâmetro seria maior do que uma mole.
Facto 4.
Uma mole de segundos é mais que todo tempo de existência do Universo.
Dados para esta demonstração: a idade do Universo é estimada em 13,8 milhares de milhões de anos6, o que equivale a cerca de \(4,35\times 10^{17}\) segundos. Novamente, um número muito inferior ao de uma mole de segundos. Olhando para facto 1, poderíamos até enunciar um novo agora: há mais moléculas em 18g de água pura do que segundos na existência do Universo.
Facto 5.
Um adulto saudável demora mais de 30 minutos para inspirar uma mole de gás oxigénio.
Esta demonstração é um pouco mais complicada. Para isso precisamos de dados sobre a respiração humana e sobre o próprio ar. Da respiração, sabemos6: volume de ar inspirado por um adulto saudável em cada ciclo: 250 mL; número de ciclos respiratórios por minuto (sem esforço) de um adulto saudável: 14. Com isto, determinamos que o volume total de ar inspirado por minuto é:
\(250mL\times 14=3500mL\)
Sobre as propriedades do ar atmosférico seco em condições ambientais normais, sabemos7: densidade do ar = \(1,20\times 10^{-3}\textrm{g}mL^{-1}\); fração de O2 no ar (em massa) = 0,231; massa molar do O2 = \(32\textrm{g mole}^{-1}\). Vamos aos cálculos.
Massa de ar inspirada por minuto, calculada a partir de (4):
\(m=d\times V=1,2\times 10^{-3}\textrm{g}mL^{-1}\times 3500mL=4,2\textrm{g}\)
O que equivale a
\(4,2\textrm{g}\times 0,231=0,97\textrm{g}\)
De gás O2.
Assim, a quantidade de moles de O
\(n=\frac{m}{M}=\frac{0,970\textrm{g}}{32\textrm{g mole}^{-1}}=0,030\textrm{ mole}\)
Portanto, para se inspirar uma mole de O
Após os factos e demonstrações apresentados, deve ser evidente que a mole é uma unidade adequada apenas para entidades elementares devido ao valor numérico da constante de Avogadro ser extremamente grande. Ainda assim, as demonstrações feitas são muito úteis para a perceção do imenso número de entidades presentes em uma mole.
Referências
- 1 https://www.bipm.org/en/committees/cg/cgpm/14-1971/resolution-3.
- 2 https://goldbook.iupac.org/terms/view/M03980.
- 3 https://oceanservice.noaa.gov/facts/oceanwater.html#:~:text=According%20to%20the%20U.S.%20Geological,miles%20is%20 in%20the%20ocean.
- 4 https://web.archive.org/web/20080120012722/https://www.hawaii.edu/suremath/jsand.html.
- 5 https://imagine.gsfc.nasa.gov/science/featured_science/milkyway/#:~:text=The%20Milky%20Way%20is%20approximately,center% 20of%20the%20Milky%20Way.
- 6 https://www.britannica.com/science/human-respiratory-system/The-mechanics-of-breathing.
- 7 https://physics.nist.gov/cgi-bin/Star/compos.pl?refer=ap&matno=104.
Este artigo já foi visualizado 3987 vezes.



