Sobre a composição do ar e a teoria do flogisto
📧
- DEQ/ ISEL
Referência Gomes, J., (2024) Sobre a composição do ar e a teoria do flogisto, Rev. Ciência Elem., V12(4):041
DOI http://doi.org/10.24927/rce2024.041
Palavras-chave
Resumo
Neste artigo faz-se uma breve resenha histórica do caminho percorrido ao longo dos anos sobre a composição dos gases do ar, desde a Antiguidade clássica até à “revolução” química, operada por Antoine Lavoisier, no século XVIII.
Maioritariamente o ar (da atmosfera terrestre) é composto por 78,084% de nitrogénio 20,946% de oxigénio e 0,934% de árgon, contendo ainda os restantes gases raros (hélio, néon, krípton e xénon), além de vapor de água, dióxido de carbono, metano, dióxido de nitrogénio e ozono; com uma massa molecular média de 28,971. Estima-se que a atmosfera da Terra tem uma massa de 5,1x1018 kg2, estendendo-se desde a superfície terrestre até uma altitude de cerca de 800 km, no limite da termosfera. Esta é a última camada a partir da qual ainda se equaciona a presença da exosfera, embora se aceite que a linha Kárman, a 100 km de altitude constitua o limite entre a atmosfera terrestre e o espaço exterior. Assim, cerca de três quartos da massa da atmosfera se encontram entre a superfície terrestre e a altitude de 11 km, em que a atmosfera se torna mais rarefeita à medida que a altitude aumenta. Naturalmente que esta informação, minimamente rigorosa, de que hoje dispomos pode ser considerada “recente”, tendo em conta que o oxigénio e o nitrogénio só foram descobertos e identificados inequivocamente em finais do século XVIII, na sequência dos trabalhos de Antoine Lavoisier, considerado o verdadeiro “pai” da Química moderna, que operou nela uma verdadeira revolução, pelo que se pode admitir que a Química, como ciência precisa digna desse nome, só aparece nesta altura, sendo que anteriormente existia pouco mais do que a alquimia. Note- -se, a este respeito, que o termo “Química” aparece referido por Robert Boyle, em 1661, como “o assunto dos princípios materiais dos corpos mistos”3, o que Christopher Glaser, em 1663, descreveu como “arte científica”, antes de vir a adquirir, posteriormente, o estatuto de Ciência. Particularmente, os trabalhos de Boyle4, que se considerava um “filósofo natural”, sobre gases têm muito a ver com a identificação dos gases e suas propriedades físicas, que vieram a ser explicitadas depois. E, na verdade, é a identificação dos gases do ar, em particular, do oxigénio e o seu papel na respiração humana, que possibilitou a dita revolução da química, a que nos referimos anteriormente.
Na realidade, esta história relativa aos gases do ar vem de muito longe, tão longe como os tempos de Empédocles de Agrigento (495 a.C.-430 a.C.) autor, pelo que se conhece, da teoria cosmogénica que considerou a existência de quatro elementos clássicos, conceção que perdurou até ao século XVIII: terra (Aidoneu), água (Nestos), ar (Hera) e fogo (Zeus). Estes são os quatro elementos fundamentais (que se representam na FIGURA 15).
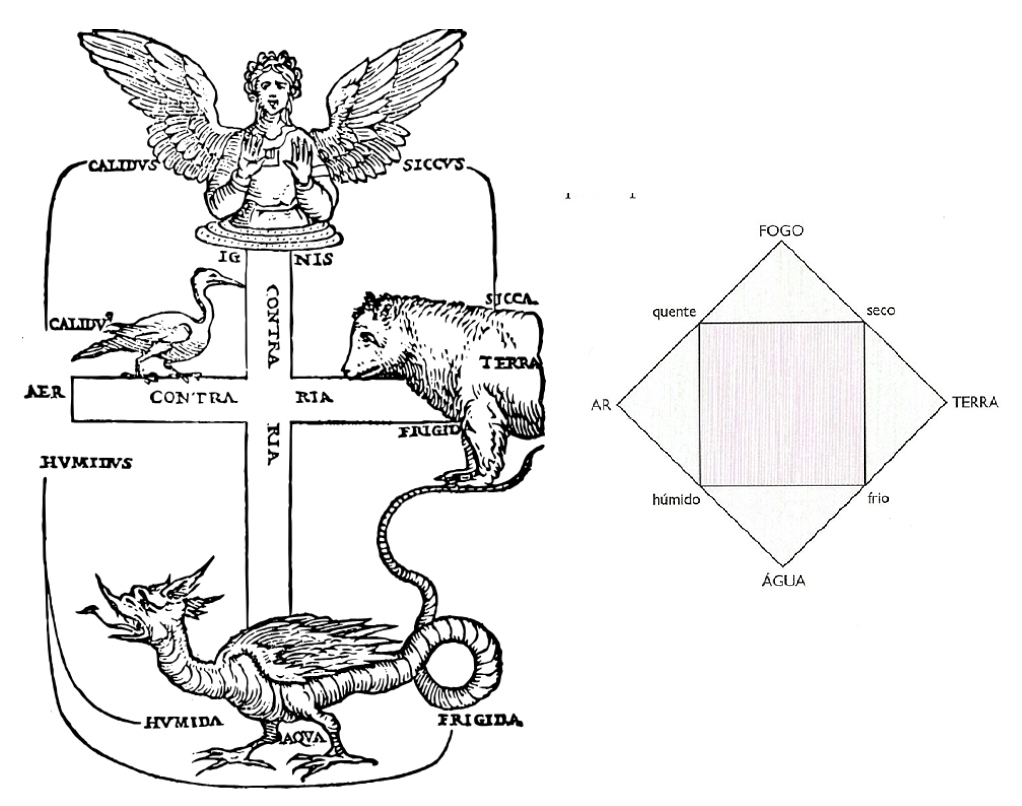
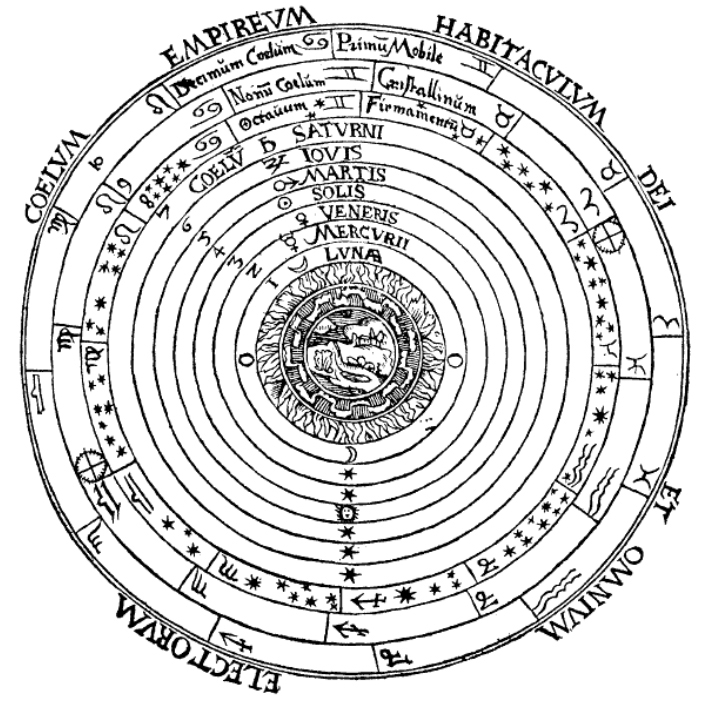
Mais tarde adicionou-se ainda o éter6, a quinta essência, para explicar o que existia acima de atmosfera terrestre, ou seja, o fluido no qual permaneciam os astros, como o Sol, a Lua e outros planetas, como se indica na FIGURA 25.
Às quatro substâncias base, também identificadas na Índia antiga, Egipto helenístico e Grécia antiga, correspondiam os quatro humores humanos, a saber, sanguíneo (ar), fleumático (água), colérico (fogo) e bilioso (terra), sendo que, na visão alquímica, a saúde do ser humano se concentrava em obter o equilíbrio entre esses humores, conforme Hipócrates, o que explica que os alquimistas sejam também considerados, desde a idade média, como físicos, ou, mais precisamente, os médicos de outrora.
Foi um médico alemão, Georg Stahl (1659-1734) que conceptualizou uma teoria algo engenhosa, a Teoria do Flogisto, que veio a ser aceite e subsistiu bastante tempo, apesar das evidentes incoerências, pois conseguia explicar, com algum sucesso diversos fenómenos relacionados com a combustão de diversas substâncias no ar, como sejam a matéria orgânica e os metais, e ainda alguns fenómenos relacionados com a respiração.
Atualmente, aceitamos que a respiração consiste num processo que envolve duas reações químicas principais:
i) oxidação do carbono, ou reação de combustão completa: C+O2 → CO2
ii) formação do vapor de água, formalmente também uma reação de oxidação do hidrogénio: H2 + ½ O2 → H2O que são duas reações exotérmicas, ou seja, que se processam com libertação de energia, sob a forma de calor. Isto permite manter os corpos em que ocorrem, quentes, e consistem na oxidação dos hidratos de carbono que ingerimos a dióxido de carbono e vapor de água, que se libertam e, entretanto, servem para transferir o oxigénio do ar para a corrente sanguínea. Por sua vez, este vai oxigenar os principais órgãos internos, e que é permutado (também na corrente sanguínea) com dióxido de carbono que é expelido pelo aparelho respiratório. Contudo, estes processos não eram conhecidos por Stahl, nem o era o oxigénio. Stahl conceptualizou a Teoria do Flogisto a partir dos trabalhos de Johan Becher (1635-1682) que definiu a existência de três tipos de terras, como substâncias base, a Terra Fluida ou Terra Mercurialis (mercúrio), a Terra Lapidea (vitrificável) e a Terra Pinguis (combustível como o enxofre)7, que não diferem muito dos elementos base enunciados por Empédocles, e têm alguma semelhança com uma noção dos alquimistas que defendiam a existência de três elementos sólidos, a Terra Prima, ou seja, mercúrio, sal e enxofre. A Terra Pinguis estava associada ao fogo, ou mais precisamente, aos combustíveis, e era libertada quando esses materiais ardiam. Este conceito foi explanado por Stahl8, postulando a existência de uma substância, ou um fluido, denominado Flogisto, do grego phlogistón (φλογιστόν = inflamável de φλόξ = chama), e que se libertaria na combustão de matéria orgânica e, igualmente, de metais, em que a “queima” de metais (calcinação) na presença de ar, é, na realidade, uma oxidação. Segundo Stahl, as substâncias que ardem no ar são ricas em flogisto, ou flogisticadas, substância esta que se liberta na combustão, sendo absorvida pelo ar, convertendo-se os combustíveis e os metais a deflogisticados, tendo o flogisto mesmo honras de símbolo alquímico, como se indica na FIGURA 39.
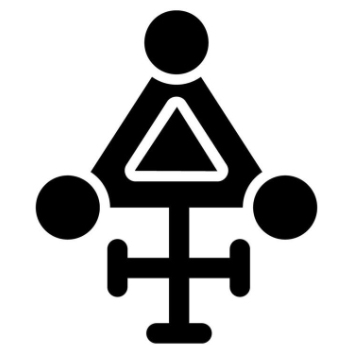
O flogisto absorvido pelo ar era, por sua vez, absorvido pelas plantas, o que explicaria que o ar não entrasse espontaneamente em combustão. O facto de a combustão cessar, em determinado momento num espaço fechado, era uma evidência de que o ar tinha capacidade para absorver uma quantidade finita de flogisto e, quando o ar estivesse completamente flogisticado, ele não poderia constituir suporte à combustão de qualquer substância e ainda o ar flogisticado não poderia ser suporte de vida. Por último, a respiração consistia em retirar flogisto dos organismos em que ocorresse. Esta teoria decorreu das muitas e precisas observações experimentais que Stahl fez dos processos de combustão e de calcinação dos metais10, 11, em que a principal diferença entre estes é que a combustão consiste num processo rápido e irreversível, enquanto a calcinação de metais é um processo lento e reversível, em que o metal, perdendo flogisto, converte-se a uma “cal” do mesmo metal, que poderá ser convertida, novamente, ao metal original com reabsorção de flogisto. Johann Pott (1692-1777), um dos discípulos de Stahl, expandiu a Teoria do Flogisto, e enunciou uma série de princípios e propriedades12, considerando que o flogisto não é uma partícula, mas sim uma essência, permeável entre substâncias. O sucesso desta teoria consiste em que ela permite explicar o facto de os combustíveis perderem massa durante a combustão, por perda de flogisto, embora não o consiga fazer relativamente à calcinação de metais, processo em que ocorre muitas vezes um ganho de massa, o que se deve ao facto de os óxidos serem moléculas mais pesadas do que o metal de partida. Esta discrepância veio a ser explicada admitindo que o flogisto não tem massa, por ser uma essência, o que não resolve totalmente o problema, a menos que se considere que o flogisto tem uma massa negativa, o que chegou a ser alvitrado por Guyton de Morveau (1737-1816). Um dos mais ardentes defensores desta teoria foi Johann Juncker (1679-1759), que enunciou que o flogisto tinha a propriedade da levitação, assim como Guillaume-François Rouelle (1703-1770), que divulgou esta teoria em França, e a transmitiu a muitos dos seus alunos, entre os quais Antoine Lavoisier (1743-1794). Curiosamente é Joseph Priestley (1733- 1804) que, ao participar na descoberta do oxigénio, a que chamou ar deflogisticado14, abre caminho para a queda da Teoria do Flogisto, sem nunca a ter abandonado definitivamente, o que lhe valeu o cognome de Doutor Flogisto (FIGURA 4), e tendo sido considerado por Georges Cuvier (1769-1832) como o “pai” da química moderna que nunca reconheceu a sua filha. Priestley terá isolado o oxigénio em 1774, ao estudar a decomposição térmica do óxido de mercúrio (2Hg2O → 4Hg + O2) e terá efetuado esta experiência em Paris, ao proferir uma conferência, a que assistiu Lavoisier e que terá recebido o pedido de Priestley para continuar esta experimentação.

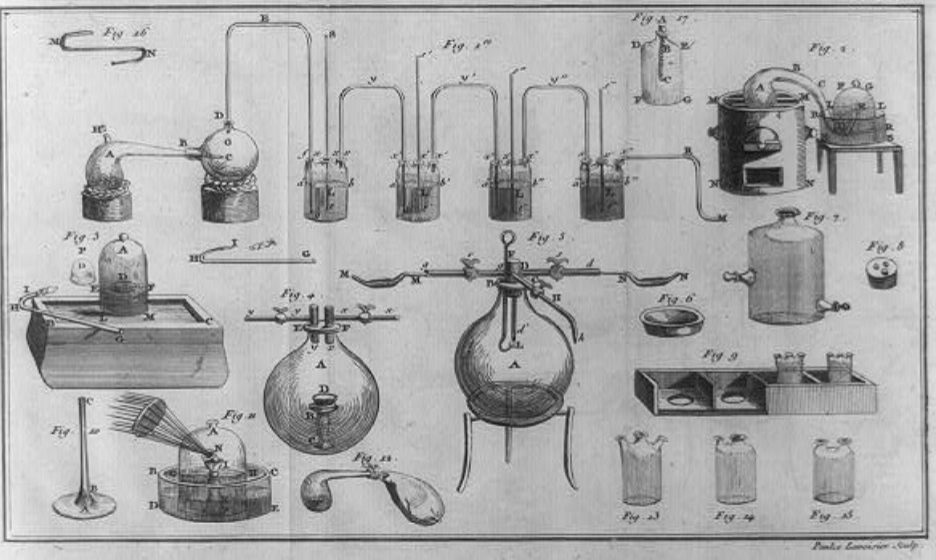
Simultaneamente, o oxigénio foi também descoberto por Carl Scheele (1742-1786) ao estudar as propriedades do óxido de manganês IV14. Com esta informação de base, Lavoisier realizou as determinações experimentais quantitativas e foi o primeiro a explicar a existência do oxigénio sem a Teoria do Flogisto17, num longo caminho em que descobriu o princípio da conservação da massa que refere num tratado publicado em 1789, embora o conceito tenha sido anteriormente referido por Lomonosov, em 1760, ao replicar determinadas experiências de Boyle. Lavoisier identificou, além do oxigénio, o hidrogénio, a água, e o nitrogénio, entre outros elementos e proposto uma nova forma de classificação dos mesmos18. Em particular, descreveu como o oxigénio participa nas combustões como elemento, oxidando substâncias e dando origem a óxidos, com base nos estudos sobre a combustão de enxofre e do fósforo, com equipamentos que nos parecem hoje tão rudimentares como os que se apresentam na FIGURA 515.
Percebeu ainda que, na combustão do carbono, este processo de oxidação conduzia à formação de uma nova espécie, que hoje sabemos ser o dióxido de carbono, e que tinha sido denominado como “ar fixo” por Joseph Black (1728-1799), ao estudar a decomposição do carbonato de cálcio (CaCO3 → CaO + CO2). Apesar da solidez da experimentação e da teoria de Lavoisier, vários químicos que defendiam a Teoria do Flogisto tentaram refutar as ideias de Lavoisier e vários tentaram até reformular a teoria original por forma a poder explicar as observações deste último, sendo que o mais famoso foi Pierre Macquer (1718-1784), apesar de ter percebido que a Teoria do Flogisto estava condenada, a defendeu sempre e procurou que esta explicasse as observações de Lavoisier19. Mais original foi Elizabeth Fulhame (1794) que discordou tanto dos adeptos do flogisto como dos anti-flogisto20. Assim, esta polémica durou longos anos, e envolveu debates e ridicularizações (FIGURA 6) após o que as teorias de Lavoisier vieram a ser universalmente aceites, o que constituiu um avanço definitivo da Química21 ao descrever com precisão os gases que constituem o ar e os processos em que eles intervêm.

Esta resenha histórica é ilustrativa dum aspeto fundamental em que o progresso da ciência, com base na investigação científica, depende em larga medida de questionamentos sucessivos e correção dos conceitos anteriormente estabelecidos. É este processo “dialético” que tem vindo fazer avançar o conhecimento dos fenómenos ditos naturais.
Referências
- 1 GOMES, J., Poluição Atmosférica: Um manual universitário, 2ª edição, Publindústria, Porto. 2010.
- 2 NASA, Earth Fact Sheet.
- 3 BOYLE, R., The Sceptical Chemist. 1661.
- 4 BOYLE, R., A Continuation of New Experiments Physico-mechanical, Touching the Spring and Weight of the Air, and Their Effects. 1669.
- 5 READ, J., From alchemy to chemistry. 1995.
- 6 PLATÃO, Timaeus. 360 a.C.
- 7 BECHER, J., Physica Subterranea. 1667.
- 8 STAHL, G., Zymoyechnia fundamentalis. 1697.
- 9 Chemistry, Encyclopedia Britannica. 1911.
- 10 STAHL, G., Experimenta et observationes chemicae. 1723.
- 11 STAHL, G., Anwendung zur Metallurgie. 1703.
- 12 POTT, J., Exercitationes chymicae. 1738.
- 13 JUNCKER, J., Conspectus chemiae theoretico-practicae. 1730.
- 14 PRIESTLEY, J., Experiments and observations on diferent kinds of air. 1774-1786.
- 15 CALADO, J., Haja Luz: Uma história da química através de tudo. 2011.
- 16 SCHEELE, C., Chemische Abhandlung von der Luft und dem Feuer. 1777.
- 17 LAVOISIER, A., Reflexions sur le phlogistique pour servir de suite à la theorie de la combustion et de la calcination. 1777.
- 18 LAVOISIER, A., Traité Elementaire de Chimie. 1789.
- 19 MACQUER, P., Elements de Chymie Theorique. 1749.
- 20 FULHAME, E., An Essay On Combustion with a View to a New Art of Dying and Painting, wherein the Phlogistic and Antiphlogistic Hypotheses are Proved Erroneous. 1794.
- 21 MAGALHÃES, B. & COSTA, A., O Flogisto na génese das teorias de Lavoisier, Química, 53, 9-14. 1994.
Este artigo já foi visualizado 3432 vezes.



