Antibióticos
Da Descoberta aos Mecanismos de Ação
📧 , 📧
- * DQB/ FC/ U. Porto
- ɫ MedinUP | DB/ FM/ U. Porto
Referência Alves, C., Benfeito, S., (2025) Antibióticos, Rev. Ciência Elem., V13(3):029
DOI http://doi.org/10.24927/rce2025.029
Palavras-chave
Resumo
As doenças infeciosas provocadas por bactérias continuam a ser uma das principais causas de mortalidade e morbilidade em todo o mundo. O uso excessivo e indiscriminado de antibióticos ao longo dos anos levou ao desenvolvimento de diversos mecanismos de resistência por parte das bactérias, comprometendo, assim, a sua eficácia. De acordo com a Organização Mundial da Saúde (OMS), a resistência antimicrobiana (RAM) representa atualmente uma das maiores ameaças à saúde pública. A erradicação completa das infeções bacterianas revela-se uma meta inatingível, uma vez que a elevada densidade de microrganismos e o seu rápido ciclo de geração favorecem o aparecimento de mutações que lhes permitem contornar os mecanismos de ação dos antibióticos. Assim, o surgimento de resistências é inevitável. A contenção da RAM exige, portanto, uma abordagem racional e responsável na utilização dos antibióticos, baseada em critérios clínicos rigorosos e sustentada por evidência científica, de forma a evitar o seu uso inadequado e excessivo. No entanto e apesar de todos os esforços, não existe uma solução terapêutica eficaz para combater a RAM, que continua a aumentar globalmente.
As doenças infeciosas são causadas por microrganismos com capacidade patogénica como bactérias, fungos, vírus e parasitas, que podem ser transmitidos entre pessoas e animais. Entre as doenças infeciosas, as infeções bacterianas destacam-se como a maior ameaça à saúde pública, tanto em contextos comunitários como hospitalares. Em 2017 a Organização Mundial da Saúde (OMS) divulgou uma lista de agentes patogénicos prioritários resistentes aos antibióticos na qual estão incluídas as bactérias Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacteriaceae, Staphylococcus aureus, Streptococcus pneumoniae e Enterococcus faecium1, 2. Os tratamentos para estas infeções bacterianas são geralmente prolongados e exigem o uso de antibióticos de amplo espectro. Embora possa ser inicialmente eficaz, esta abordagem também afeta bactérias benéficas, desregulando o microbiota natural. Como resultado, as bactérias patogénicas e oportunistas desenvolvem mecanismos para contrariar a ação dos antibióticos, contribuindo para o aumento da resistência bacteriana aos antibióticos e limitando as opções terapêuticas para infeções graves3.
As bactérias patogénicas podem ser divididas em dois grandes grupos, as bactérias de Gram-positivo e as bactérias de Gram-negativo (FIGURA 1). A diferenciação das bactérias é realizada por meio da técnica de coloração de Gram, que permite classificá-las com base na composição e nas propriedades físico-químicas das suas paredes celulares. Essa técnica utiliza um corante específico que, dependendo da estrutura da parede celular, possibilita distinguir entre os diferentes tipos de bactérias3, 4, 5, 6, 7. De facto, as bactérias Gram-positivo possuem uma única membrana celular composta por uma espessa camada de peptidoglicanos enriquecida com ácido teicóico. Por outro lado, as bactérias Gram-negativo apresentam uma camada mais fina de peptidoglicanos e uma membrana externa adicional composta por lipopolissacarídeos. Contudo, ambas têm na sua composição uma membrana interna constituída por proteínas e fosfolípidos4, 7, 8, 9, 10.
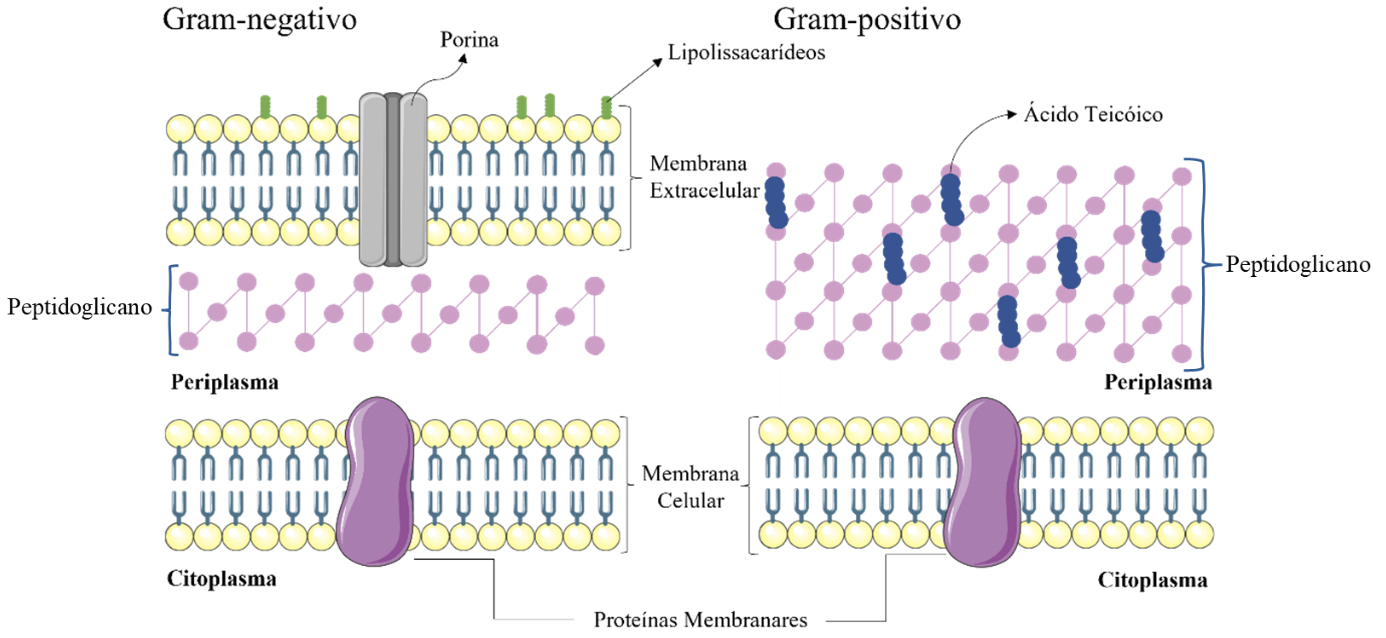
Esta diferenciação é muito importante a nível hospitalar na medida em que permite monitorizar a infeção e determinar os tipos de tratamentos mais convenientes. Pelas diferenças de cada tipo de bactéria é de esperar que as bactérias de Gram-negativo sejam mais resistentes aos antibióticos tendo em conta a complexidade da parede celular8.
Ao longo dos anos foram implementadas diversas diretrizes para combater a resistência antimicrobiana (RAM), incluindo estratégias para o uso racional de antibióticos, maior seletividade na escolha do tratamento com base no agente patogénico, campanhas de consciencialização e a redução do uso de antibióticos em animais11. No entanto, até o momento, os avanços no desenvolvimento de novos antibióticos têm sido limitados12. A descoberta do primeiro composto sintético, o Salvarsan, ocorreu em 1910 por Ehrlich5. Alguns anos depois começaram a ser introduzidos outros agentes antibacterianos sintéticos como a proflavina e o prontosil. Este último, pertencente à classe das sulfonamidas, desempenhou um papel crucial durante a Segunda Guerra Mundial, sendo amplamente utilizado no tratamento de soldados feridos13, 14, 15. Vinte anos depois, teve início uma nova era conhecida como a “Era Dourada”. Esta designação deve-se à descoberta do primeiro verdadeiro antibiótico, a Penicilina, por Alexander Fleming em 1928. Esse marco revolucionou a ciência e impulsionou a descoberta de uma vasta gama de antibióticos13, 14, 15.
Os antibióticos englobam compostos naturais, semi-sintéticos e sintéticos com atividade antibacteriana, ou seja, capazes de inibir a proliferação bacteriana (bacteriostáticos) ou provocar a morte de bactérias (bactericidas)5. Atualmente, existem diversas classes de antibióticos, categorizados com base na sua estrutura química, o que determina diferentes mecanismos de ação e, consequentemente, distintos alvos terapêuticos.
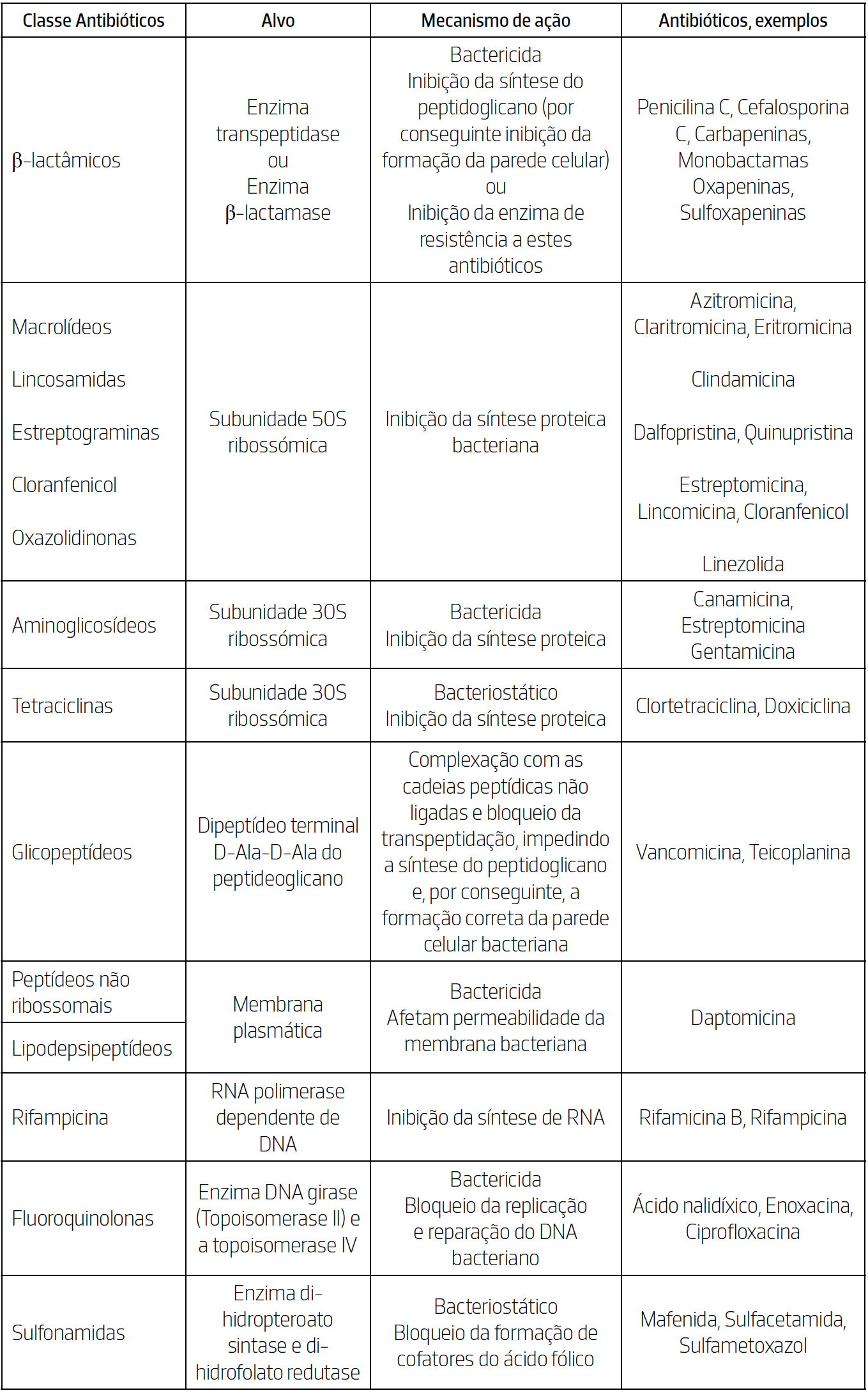
A classe dos β-lactâmicos, que inclui a penicilina e a cefalosporina foi a primeira a ser descoberta e continua a ser uma das mais amplamente utilizadas na terapêutica antimicrobiana. Estes antibióticos têm como mecanismo de ação a inibição da síntese da parede celular das bactérias, um processo essencial para a viabilidade e integridade estrutural das bactérias, tendo como principais alvos a enzima transpeptidase e as β-lactamases16, 17. As enzimas transpeptidases, também conhecidas como PBPs (penicillin-binding proteins) estão localizadas na membrana citoplasmática das bactérias e catalisam a etapa final da síntese do peptidoglicano, promovendo as ligações cruzadas entre cadeias de glicano, essenciais para a rigidez e estabilidade da parede celular. Os antibióticos β-lactâmicos (penicilina C, cefalosporina C, carbapeninas e monobactamas) mimetizam a estrutura da extremidade terminal do substrato natural (D-Ala-D-Ala) e ligando-se covalentemente ao sítio ativo da transpeptidase inibem irreversivelmente a sua atividade. Esta inibição compromete a síntese da parede celular, levando à lise e, consequentemente, à morte bacteriana16, 17. Por outro lado, as enzimas β-lactamases são enzimas produzidas por alguns microrganismos como mecanismo de resistência aos antibióticos β-lactâmicos. A sua ação consiste na hidrólise do anel β-lactâmico, estrutura essencial para a atividade destes antibióticos, resultando na sua inativação antes que possam alcançar e inibir as PBPs. Nas bactérias Gram-negativo, estas enzimas estão localizadas no espaço periplasmático, onde interceptam os antibióticos que atravessam a membrana externa. Por sua vez, nas bactérias Gram-positivo, as β-lactamases são secretadas para o meio extracelular, onde atuam de forma preventiva, degradando os antibióticos antes que estes consigam atingir a membrana citoplasmática. Para contornar esta forma de resistência, foram desenvolvidos inibidores de β-lactamases, como as oxapeninas e sulfoxapeninas, que possuem uma estrutura β-lactâmica, ligando-se de forma covalente e irreversível ao centro ativo das β-lactamases. Dessa forma, impedem a degradação dos antibióticos β-lactâmicos administrados, restaurando a sua eficácia contra estirpes bacterianas produtoras de β-lactamases.
Com o passar do tempo, surgiram novos agentes antibacterianos de diferentes classes, incluindo compostos de origem natural, sendo a maioria deles eficaz no tratamento de infecções por bactérias Gram-positivo, como a cloranfenicol, a estreptomicina, a eritromicina, a rifamicina B, a rinfampicina, a daptomicina e a vancomicina. Já entre os antibióticos de origem semi-sintética, destacam-se a clindamicina, pertencentes à classe das lincosamidas, bem como a quinupristina e a dalfopristina, da classe das estreptograminas5, 6, 13. Posteriormente, foram introduzidos novos antibióticos de origem sintética como o ácido nalidíxico, a enoxacina e a ciproflaxacina, da classe das fluoroquinolonas, além da linezolina, pertencente à classe das oxazolidinonas5, 13. As fluoroquinolonas são antibióticos de amplo espectro que exercem uma ação bactericida através da inibição de enzimas essenciais ao metabolismo do DNA bacteriano, nomeadamente, DNA-girase (topoisomerase II) e a topoisomerase IV, fundamentais para os processos de replicação, transcrição e reparação do DNA nas bactérias. Ao inibir essas enzimas, impede-se o superenrolamento e a separação correta das cadeias de DNA, o que bloqueia os processos de replicação, transcrição e reparação do material genético bacteriano. Como resultado, ocorre a interrupção do ciclo celular bacteriano e a consequente morte da célula. Este mecanismo de ação explica a elevada eficácia bactericida das fluoroquinolonas e justifica o seu amplo uso no tratamento de infeções causadas por bactérias Gram- -negativo e Gram-positivo.
Os antibióticos que inibem a síntese proteica bacteriana atuam especificamente sobre os ribossomas, estruturas essenciais para a tradução do RNA mensageiro (mRNA) em proteínas. Os ribossomas bacterianos são compostos por duas subunidades — 30S e 50S — que desempenham funções distintas e complementares16, 18, 19, 20. A subunidade 30S é responsável pela leitura do mRNA e pelo emparelhamento correto com os anticodões do RNA transferência (tRNA); enquanto a subunidade 50S catalisa a formação das ligações peptídicas entre aminoácidos e facilita a translocação do ribossoma ao longo do mRNA. Os antibióticos dirigidos à subunidade 50S incluem os macrolídeos (azitromicina, claritromicina e eritromicina), as lincosamidas (clindamicina), as estreptograminas (dalfopristina e a quinupristina), o cloranfenicol (estreptomicina e lincomicina) e as oxazolidinonas (linezolida). Estas classes interferem com diferentes etapas da síntese proteica, nomeadamente:os macrolídeos, lincosamidas e estreptograminas inibem o alongamento da cadeia polipeptídica ao bloquearem o canal de saída do peptídeo ou impedirem a translocação ribossómica; o cloranfenicol atua ao nível do centro peptidiltransferásico, impedindo a formação da ligação peptídica; e as oxazolidinonas bloqueiam a formação do complexo de iniciação da tradução, inibindo a montagem funcional do ribossoma. Já os antibióticos que atuam sobre a subunidade 30S incluem os aminoglicosídeos e tetraciclinas. As tetraciclinas (clortetraciclina e doxiciclina) ligam-se reversivelmente à subunidade 30S, impedindo a ligação do tRNA ao codão do mRNA, o que bloqueia o alongamento da cadeia polipeptídica e resulta num efeito bacteriostático. Por outro lado, os aminoglicosídeos (canamicina, estreptomicina e gentamicina) ligam-se de forma irreversível à mesma subunidade, provocando erros de leitura do mRNA e a síntese de proteínas danificadas, o que leva à morte celular, conferindo-lhes um efeito bactericida.
Por outro lado, os antibióticos da classe dos peptídeos não ribossomais e dos lipodepsipeptídeos têm como alvo a membrana plasmática da bactéria, afetando a sua permeabilidade. Os peptídeos não ribossomais aumentam a permeabilidade da membrana bacteriana por meio de interações eletrostáticas com os lipídios aniónicos presentes na membrana. Este processo geralmente envolve a ligação do peptídeo à superfície da membrana, causando a sua desestabilização, a formação de poros ou até a fusão parcial das membranas, o que leva à perda da integridade celular e à morte da bactéria. Já os lipodepsipeptídeos, que são uma subclasse dos peptídeos não ribossomais, possuem na sua estrutura resíduos lipídicos e ligações éster. Um exemplo é a daptomicina, cujo mecanismo de ação envolve a despolarização da membrana celular ao induzir o efluxo de potássio e concomitante deficiência de gradientes iónicos essenciais, resultando na perda do potencial elétrico necessário para funções vitais da célula, como a síntese de proteínas, DNA e RNA, culminando na morte bacteriana16, 20, 21.
Os antibióticos da classe das rifamicinas (rifamicina B e rifampicina) atuam inibindo a RNA polimerase dependente de DNA, uma enzima essencial para a transcrição genética nas bactérias. Ligam-se fortemente à subunidade β da enzima, bloqueando o canal de saída do RNA e impedindo o início da transcrição e o alongamento de todos os tipos de RNA essenciais para a produção proteica bacteriana, o que leva à morte celular. A rifampicina, um dos antibióticos mais utilizados desta classe, apresenta atividade bactericida de largo espetro, sendo especialmente eficaz contra microrganismos do género Mycobacterium, incluindo M. tuberculosis.
Por fim, os antibióticos da classe das sulfanamidas, atuam bloqueando a formação de cofatores do ácido fólico, um componente essencial para a replicação do DNA e para a proliferação bacteriana. Os antibióticos desta classe inibem enzimas-chave, tais como a di-hidropteroato sintase e a di-hidrofolato redutase, envolvidas na biossíntese daqueles cofatores, comprometendo a síntese dos ácidos nucleicos e, consequentemente, a proliferação das bactérias21.
Tendo em conta a variedade de classes de antibióticos há vários outros mecanismos para contornar a sobrevivência das bactérias. Na TABELA 1 apresentam-se resumidamente as diferentes classes de agentes antibacterianos, os diferentes alvos e respetivos mecanismos de ação.
Apesar da diversidade de agentes antibacterianos atualmente disponíveis, a RAM continua a aumentar de forma preocupante, sem que uma solução terapêutica totalmente eficaz tenha sido alcançada. Esta realidade destaca a notável capacidade dos agentes patogénicos em evoluir e preservar mecanismos de resistência, mesmo frente à diversidade de antibióticos disponíveis. A emergência contínua de resistências impõe um desafio constante à eficácia das abordagens disponíveis, tornando imperativo o desenvolvimento de estratégias antimicrobianas inovadoras, seguras e eficazes, que possam contribuir para mitigar este problema. Neste cenário, a compreensão aprofundada dos mecanismos de resistência microbiana é essencial para orientar essas estratégias. Importa ainda salientar que a mitigação da RAM depende não só da inovação científica, mas também da aplicação rigorosa de medidas de saúde pública, nomeadamente a utilização racional, criteriosa e responsável dos antibióticos, evitando o seu uso excessivo e inadequado.
Referências
- 1 MANCUSO, G. et al., Bacterial Antibiotic Resistance: The Most Critical Pathogens, Pathogens, 10, 1310- 1324. 2021.
- 2 WHO, Prioritization of pathogens to guide discovery, research and development of new antibiotics for drug-resistant bacterial infections, including tuberculosis, World Health Organization, Geneva (WHO/EMP/IAU/2017.12). 2017.
- 3 JIAN, Z. et al., Antibiotic resistance genes in bacteria: Occurrence, spread, and control, J. Basic Microbiol., 61, 1049-1070. 2021.
- 4 LIMA, M. et al., ?-lactam antibiotics: An overview from a medicinal chemistry perspective, Eur. J. Med. Chem., 208, 112829. 2020.
- 5 HUTCHINGS, M. et al., Antibiotics: past, present and future, Cur. Opin. Microbiol., 51, 72-80. 2019.
- 6 KISIL, O. et al., Looking Back to Amycolatopsis: History of the Antibiotic Discovery and Future Prospects, Antibiotics (Basel), 10. 2021.
- 7 ARAUJO, A. R. et al., Vescalagin and Castalagin Present Bactericidal Activity toward Methicillin-Resistant Bacteria, ACS Biomater. Sci Eng., 7, 1022-1030. 2021.
- 8 MATAMOROS-RECIO, A. et al., Understanding the Antibacterial Resistance: Computational Explorations in Bacterial Membranes, ACS Omega, 6, 6041-6054. 2021.
- 9 KARAMAN, R. et al., Resistance of Gram-Positive Bacteria to Current Antibacterial Agents and Overcoming Approaches, Molecules, 25. 2020.
- 10 CREMIN, K. et al., Scanning Ion Conductance Microscopy Reveals Differences in the Ionic Environments of Gram-Positive and Negative Bacteria, Anal. Chem., 92, 16024-16032. 2020.
- 11 MICHAEL, C. et al., The antimicrobial resistance crisis: causes, consequences, and management, Front. Public Health, 2, 145. 2014.
- 12 MORRISON, L. & ZEMBOWER, T., Antimicrobial Resistance, Gastrointest. Endosc. Clin. N. Am., 30, 619-635. 2020.
- 13 UDDIN, T. et al., Antibiotic resistance in microbes: History, mechanisms, therapeutic strategies and future prospects, J. Infect. Public Health, 14, 1750-1766. 2021.
- 14 DURAND, G. et al., Antibiotic discovery: history, methods and perspectives, Int. J. Antimicrob. Agents, 53, 371-382. 2019.
- 15 SPAGNOLO, F. et al., Why Do Antibiotics Exist?, mBio, 12, e01966-01921. 2021.
- 16 NUSSBAUM, F. et al., Antibacterial natural products in medicinal chemistry--exodus or revival?, Angew Chem. Int. Ed. Engl., 45, 5072- 5129. 2006.
- 17 SUÁREZ, C. & GUDIOL, F., Beta-lactam antibiotics, Enferm. Infecc. Microbiol. Clin., 27, 116-129. 2009.
- 18 DURANTE-MANGONI, E. et al., Do we still need the aminoglycosides?, Int. J. Antimicrob. Agents, 33, 201-205. 2009.
- 19 MUKHTAR, T. & WRIGHT, G., Streptogramins, oxazolidinones, and other inhibitors of bacterial protein synthesis, Chem. Rev., 105, 529- 542. 2005.
- 20 BOZDOGAN, B. & APPELBAUM, P., Oxazolidinones: activity, mode of action, and mechanism of resistance, Int. J. Antimicrob. Agents, 23, 113-119. 2004.
- 21 BRÖTZ-OESTERHELT, H. & BRUNNER, N., How many modes of action should an antibiotic have?, Curr. Opin. Pharmacol., 8, 564-573. 2008.
Este artigo já foi visualizado 1012 vezes.



