Radicais livres
📧
- Universidade do Porto
Referência Corrêa, C., (2014) Radicais livres, Rev. Ciência Elem., V2(1):028
DOI http://doi.org/10.24927/rce2014.028
Palavras-chave Química; Orgânica;
Resumo
A palavra radical era utilizada em Química Orgânica para designar um agrupamento de átomos ligados entre si, como o radical metilo, CH3, que existia ligado a outros átomos, formando compostos estáveis, como o tolueno, CH3-Ph, o cloreto de metilo, CH3-Cl, e muitos outros. Não se sabia que o radical metilo podia existir livremente, desligado de outros átomos, constituido um radical livre.
Em 1900, o químico Mose Gomberg (1866-1947) verificou que o hidrocarboneto hexafeniletano, Ph3C-CPh3, se dissociava gerando dois radicais trifenilmetilo, Ph3C, o primeiro radical livre orgânico identificado. Wieland, em 1915, considerou os radicais livres como "complexos de valência anormal que possuem propriedades aditivas, mas que não possuem carga elétrica e não são iões livres." Note-se que esta definição não inclui os iões-radicais.
A característica fundamental de um radical livre, a sua essência, é a existência de um eletrão desemparelhado, isto é, de orbitais semipreenchidas. A IUPAC (Gold Book) define radical livre como "uma entidade molecular como CH3•, SnH3• e Cl•, que possui um eletrão desemparelhado". Repare-se que esta definição não parece muito apropriada, pois refere "entidade molecular" e inclui o átomo de cloro como radical. Note-se também, que não se excluem os metais de transição, que possuem eletrões desmparelhados em orbitais atómicas internas.
Assim, é preferivel definir radical livre, ou simplesmente radical*, como uma "partícula (atómica ou molecular) que possui um eletrão desemparelhado numa orbital (atómica ou molecular) externa". Esta definição exclui os átomos dos metais de transição, mas inclui átomos de metais alcalinos e de halogénios (Na•, Cl•, etc.).
Se existirem dois eletrões desemparelhados (dois centros radicalares) em átomos diferentes, independentes um do outro, a partícula será um birradical, como é o caso de •CH2-CH2-CH2•.
Os radicais podem ser produzidos por a) cisão homolítica de uma ligação covalente (fotólise, termólise e radiólise) e por b) transferência eletrónica (oxidação e redução):
a)
CH3-Br \( \to \)
CH3• +
Br•
Ph3C-CPh3 \( \to \) 2
Ph3C•
H2O + Raios gama \( \to \)
H2O+ • + e-
b)
R-COOH + Ce4+ \( \to \)
R-COO• + Ce3+ +
H+
H2O2 + Fe2+ \( \to \)
HO• + HO- + Fe3+
Os radicais são partículas normalmente muito reativas, embora existam radicais de elevada estabilidade (termodinâmica e cinética). A estabilidade termodinâmica de um radical depende da natureza do átomo onde se situa o eletrão desemparelhado e da deslocalização do eletrão desemparelhado.
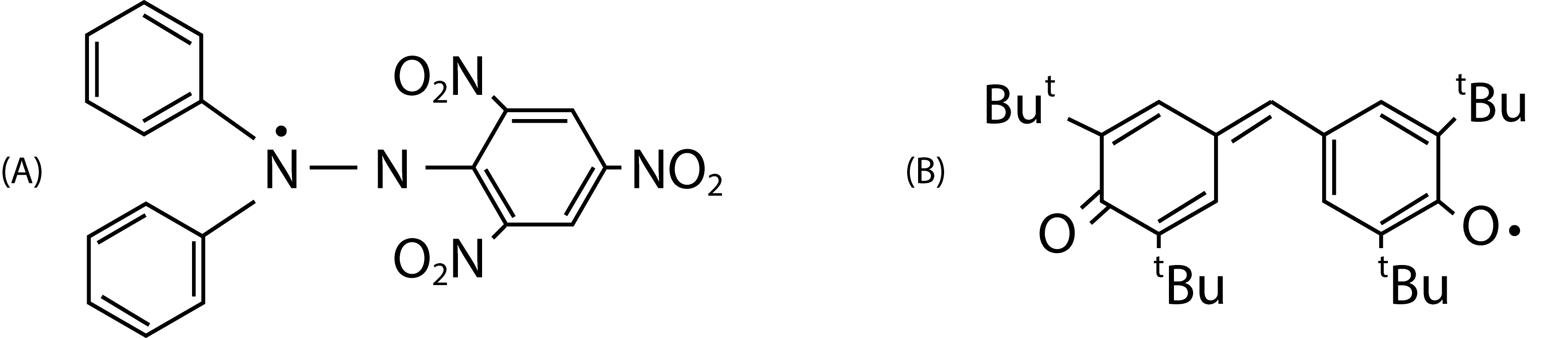
Se o período de semitransformação do radical, t1/2, é maior que 10-3 s, o radical diz-se "estável", o que se deve a uma intensa deslocalização eletrónica do eletrão desemparelhado, como sucede nos radicais difenilpicril-hidrazilo (A) e galvinoxilo (B), que são sólidos cristalinos que se podem conservar vários meses sem apreciável decomposição.
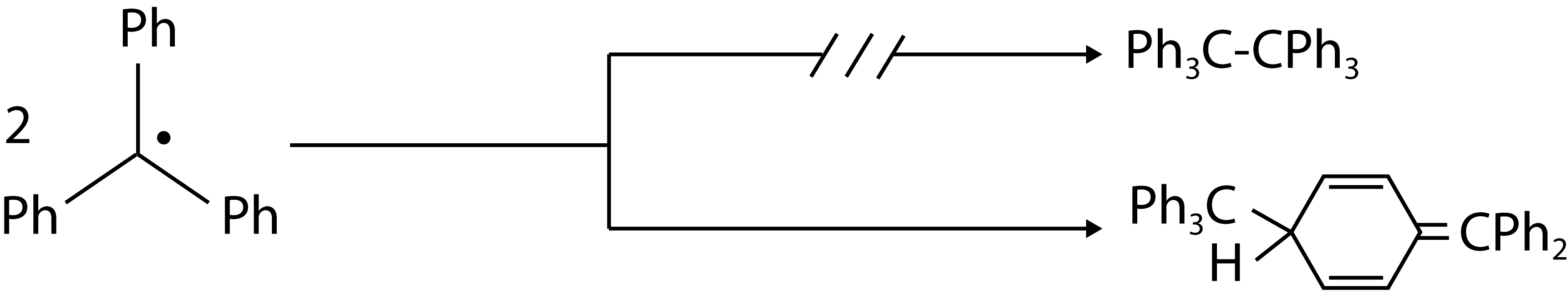
A estabilidade radicalar pode também resultar de fenómenos cinéticos, isto é, baixas velocidades de reação normalmente resultantes de fenómenos estereoquímicos em torno do centro radicalar como sucede no radical tris(trimetilsilil)metilo, [CH3)3Si]3C•, que apresenta t1/2 de cerca de 200 segundos. O radical trifenilmetilo deve a sua estabilidade à dificuldade de dimerizar devido à presença de três grupos volumosos em torno do carbono radicalar (a deslocalização eletrónica é baixa porque os grupos fenilo não se encontram no mesmo plano devido ao seu tamanho). Em vez de dimerizar, prefere atacar um dos aneis de outro radical:
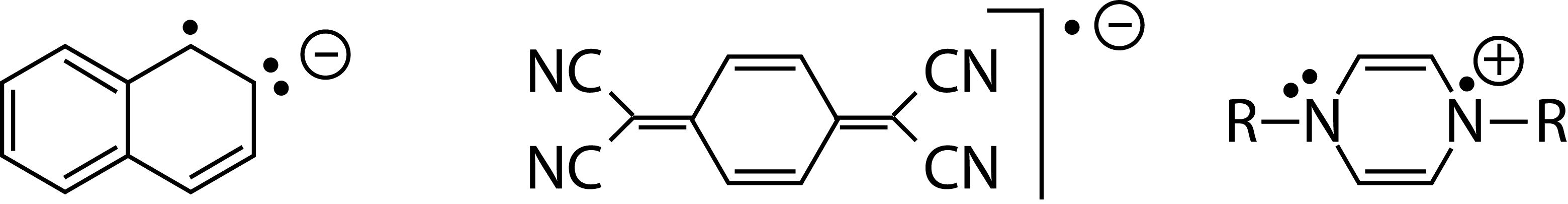
Os radicais podem ser carregados eletricamente (iões-radicais) como os aniões-radicais derivados do naftaleno e do tetracianoquinonadimetano (TCNQ) e o catião-radical do sal de Weitz:
Os radicais podem reagir por:
a)
Combinação
CH3• +
CH3• \( \to \) CH3-CH3
(dimerização)
CH3CH2• +
CH3CH2• \( \to \)
CH3-CH3 + CH2=CH2
(dismutação)
b) Remoção de átomos:
CH3• + CH3-CH3 \( \to \)
CH4 +
CH3-CH2•
CH3•
+ CH3-CH2Cl \( \to \) CH3Cl +
CH3-CH2•
c) Adição a ligações múltiplas:
CCl3• + CH2=CH-CH3 \(
\to \) CCl3-CH2-CH•-CH3
d) Fragmentação:
(CH3)3C-O• \( \to \) CH3-CO-CH3
+ CH3•
e) Abertura de aneis:

f) Substituição aromática:
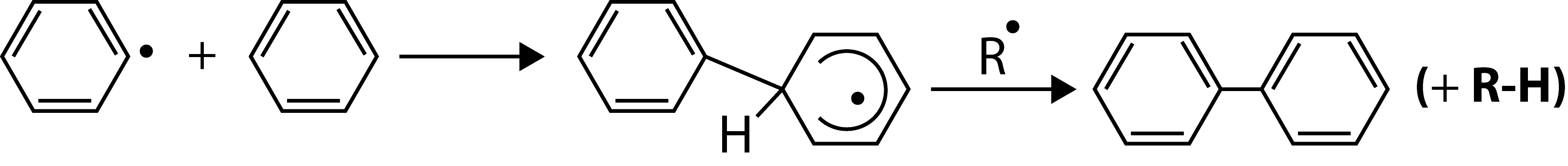
As mais importantes aplicações industriais das reações de radicais livres são a polimerização por adição (75% dos polímeros), a cloração fotoquímica, as oxidações por oxigénio atmosférico (corantes, fenol, ácido adípico) e a combustão de hidrocarbonetos (obtenção de energia). Atualmente, descobriu-se que os radicais livres desempenham papeis muito importantes em Biologia e Medicina.
Materiais relacionados disponíveis na Casa das Ciências:
- Em busca da verdade, de João Ricardo Soares.
Este artigo já foi visualizado 5138 vezes.



