O Grafeno
📧
- CFP/CFUM/ Universidade do Porto
Referência Lopes dos Santos, J.M.B, (2014) O Grafeno, Rev. Ciência Elem., V2(2):030
DOI http://doi.org/10.24927/rce2014.030
Palavras-chave Carbono; químicos;
Resumo
Não há dúvida que o elemento Carbono é a maior dádiva de Deus aos químicos. A sua versatilidade é tal que existe uma especialidade de Química dedicada apenas aos compostos deste elemento. É verdade que essa versatilidade só se revela integralmente quando consideramos substâncias que incluem outros átomos, como os de hidrogénio, azoto ou oxigénio, para mencionar apenas alguns dos mais comuns na química do carbono. Mas só por si, o carbono já surpreende.
O átomo de carbono tem número atómico Z = 6, e portanto 6 eletrões. A química deste elemento é determinada pelos estados disponíveis para os quatro eletrões com menor energia de ligação: uma orbital s e três orbitais p. As orbitais são ondas estacionárias, e tal como as ondas, podem sobrepor-se, ou, na linguagem da Química, hibridizar-se. Para descrever os estados dos electrões nas ligações químicas do carbono, algumas hibridizações são mais convenientes que outras. Uma delas, designada por sp3, inclui as quatro orbitais referidas e é conveniente para descrever moléculas em que o carbono forma quatro ligações covalentes, dirigidas segundo as direções do centro para os quatro vértices de um tetraedro; esta hibridização está presente na molécula de metano (CH4) e na estrutura do diamante, que tem apenas átomos de carbono.
No grafeno a hibridização é do tipo sp2: A orbital s combina-se com duas orbitais p para formar 3 orbitais planares formando ângulos de 120º. Cada uma dessas orbitais tem um eletrão, e nada a faria mais feliz (energeticamente falando) do que juntar-se com outra semelhante, por exemplo, com uma das 3 orbitais sp2 de outro átomo de carbono. Assim não surpreende que átomos de carbono se organizem numa estrutura planar formada por hexágonos regulares, cujos vértices são ocupados por um átomo: o grafeno. Cada ligação tem dois eletrões, o que torna a estrutura muito plausível.

Com efeito, Pauling, no seu clássico The Nature of the Chemical Bond1, publicado pela primeira vez em 1939, já discute as propriedades do grafeno. Raciocinando com base no benzeno, tenta explicar o comprimento das ligações C–C. Em 1947, Russel Wallace, ignorando completamente as interações entre eletrões calculou a estrutura eletrónica do grafeno, obtendo o que é hoje a descrição aceite, a discutir mais à frente. Convém também lembrar que a grafite, uma forma tão comum de carbono (se tem um lápis, tem grafite) é simplesmente constituída por empilhamento de camadas de grafeno.
Se o grafeno é notícia velha, porquê então tanta excitação recente com este material?
Uma coisa é saber que um material faz sentido do ponto de vista químico, outra é fabricá-lo, isolá-lo e medir as suas propriedades. Isso só foi conseguido em 2004 por Andre Geim e Kostya Novoselov da Universidade de Manchester. Na realidade, Geim e Novoselov não fabricaram o grafeno de raiz. Conseguiram isolar uma camada extraída da grafite e localizaram-na com um microscópio ótico —as suas dimensões laterais eram apenas de alguns micra; um mícron é um milésimo de milímetro—, o que lhes permitiu começar a estudar as suas propriedades eléctricas. Um vídeo do grupo de Barbaros Özyilmaz2 ilustra o método usado por Geim e Novoselov. Este método já deu posteriormente origem a cristais visíveis a olho nu, de dimensões da ordem do milímetro, mas não é escalável para produção em massa. Contudo, o interesse neste material foi tal que, menos de 6 anos após a sua descoberta, a Samsung já dispunha de métodos para produzir folhas de grafeno com 75 cm de diagonal!
Quais são então essas notáveis propriedades do grafeno?
Primeiro de tudo existe! De facto, é o primeiro material ordenado, estritamente bi-dimensional, planar, com a espessura de um único átomo, isolado e medido. Havia boas razões para pensar que a ordem cristalina e a natureza bi-dimensional deviam ser incompatíveis, e foi uma surpresa encontrar cristais de grafeno, com tão poucos defeitos, ordenados e coerentes em dimensões laterais macroscópicas. O próprio grupo de Manchester mostrou logo em 2005 que, partindo de outros materiais, que como a grafite são constituídos por camadas fracamente ligadas, é possível produzir outros cristais bi-dimensionais.
Imagine agora o(a) leitor(a) que a sua caixa de ferramentas não continha o alicate, porque ainda não fora inventado, ou porque se pensava que tal instrumento violava as leis da Física. Se lhe pusessem um na mão é possível que não imaginasse logo tudo o que poderia fazer com ele. Quem sabe se, passado algum tempo, não lhe ocorreria uma variação tão importante como … a tesoura!
Para os cientistas e engenheiros que trabalham com materiais, descobrir que é possível fabricar e manipular estruturas com a espessura de um átomo, que podem existir isoladamente, é como descobrir uma nova ferramenta; podemos não saber logo para que servirá, mas é óbvio que permitirá fazer coisas que não eram possíveis antes.
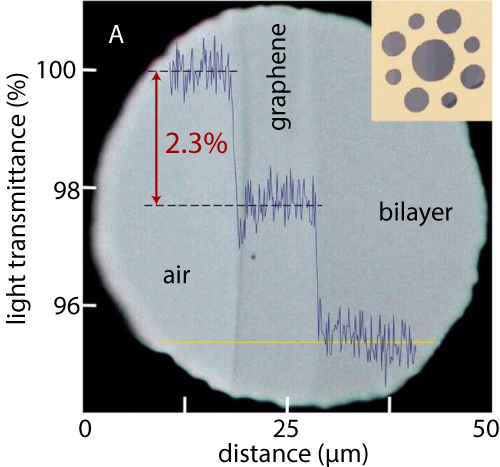
Pense numa folha de grafeno como se fosse um tecido. A modéstia impede-nos de usar roupa só feita de uma camada de grafeno, pois é quase transparente—só absorve 2,3% da luz, na gama do visível, o que, mesmo assim, dá contraste suficiente para o vermos (figura 2).
É um tecido elástico, como a Lycra. Consegue-se esticar reversivelmente cerca de 20%, mas requer muita força: cerca de 10 vezes mais do que a necessária para obter a mesma deformação numa folha do melhor aço, com a mesma espessura, cerca de 3Å. O aço, claro, cede muito antes de uma deformação relativa de 20%.
O grafeno também é difícil de furar. Pressionando uma folha de grafeno com uma agulha de dimensões atómicas—uma ponta de diamante de 20 nanómetros de raio—, é possível medir a força que é necessária para o perfurar3. Citando James Hone de Columbia, que fez estas medições:
"Para pôr as coisas em perspectiva: se uma folha de ‘cling film’ (que tem uma espessura de cerca de 0,1mm) tivesse a mesma resistência intrínseca que o grafeno, necessitaria de uma força de 20,000 N (peso de 2000 kg) para ser perfurada por um lápis."
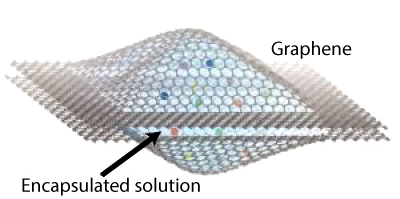
O grafeno é ainda um excelente impermeável. A malha é demasiado pequena para permitir a passagem de moléculas de água; a distância entre carbonos vizinhos, o lado do hexágono, é apenas de 1,42Å. Na verdade é impermeável a quase tudo. Nem um átomo de hidrogénio consegue difundir através da membrana. Mas a luz e um feixe de electrões conseguem, e estas propriedades já permitiram uma curiosa aplicação do grafeno. Cientistas do Berkeley Lab e da Universidade da Califórnia, criaram uma botija de grafeno, contendo uma gota de água, no campo de um microscópio eletrónico de transmissão e puderam fazer um filme da formação em tempo real de nano-cristais de platina4.
Estas propriedades mecânicas resultam da enorme estabilidade das ligações planares C–C da folha de grafeno e da quase ausência de defeitos nestes cristais; os defeitos reduzem drasticamente a resistência dos materiais.
Mas foram sobretudo as propriedades electrónicas deste material que o tornaram uma estrela da ciência. Se esteve atento(a), terá reparado que na descrição da formação das orbitais sp2 deixámos de fora uma das orbitais p. Em cada átomo de carbono, com a formação das três orbitais sp2, sobra uma orbital, aquela em que a densidade de carga eletrónica se concentra na direção perpendicular ao plano de grafeno, a orbital pz. Cada pz tem um electrão. A hibridização pz - pz dá origem a N / 2 orbitais ligantes e N / 2 orbitais anti-ligantes, em que N é o número total de átomos de carbono; como cada orbital tem dois estados de spin, no estado de mais baixa energia os N electrões ocupam as orbitais ligantes. As N orbitais do cristal têm energias diferentes, formando duas “bandas” quasi-contínuas (N é muito grande); os estados ligantes constituem a banda de valência e os anti-ligantes a banda de condução. Isto não é específico do grafeno; é uma descrição geral da formação dos estados eletrónicos num cristal, a partir de um conjunto de orbitais atómicas. Quando as bandas estão separadas por uma energia finita—um “gap” ou hiato—, o material é um isolador. Os eletrões na banda de valência não podem mover-se, porque todos os estados estão ocupados; é preciso pagar uma energia finita para excitar um electrão para a banda de condução, que pode então mover-se no cristal. O estado vazio da banda de valência também permite movimento de carga. Se as duas bandas se sobrepõem, os eletrões são móveis e o sistema é metálico. Para entender as propriedades eletrónicas do grafeno temos de discutir em mais detalhe a natureza dos estados das bandas de valência e condução.
Em mecânica quântica os estados eletrónicos são ondas; para um eletrão livre, sem forças de atração nucleares, o estado mais simples é uma onda plana, que preenche todo o espaço; o eletrão não tem preferência por nenhum ponto particular, pois não existem variações de energia potencial. Tal onda descreve um eletrão com momento linear de módulo dado pela fórmula de de Broglie, \(p = h/\lambda \), e com a direção e sentido de propagação da onda. A energia do eletrão é puramente cinética, \(E = m{v^2}/2\) ou \(E = {p^2}/2m\).
No grafeno o eletrão não é livre, pois só tem uma orbital disponível em cada átomo de carbono, mas também não tem preferência por qualquer delas. As ondas que descrevem as orbitais ligantes e anti-ligantes são semelhantes a ondas planas, no sentido em que são hibridizações de todas as orbitais pz do cristal, e, além disso, são caracterizadas por uma grandeza semelhante ao momento linear—momento de Bloch—, que determina como a fase da onda varia de orbital para orbital. Contudo a relação entre a energia do estado e o respetivo momento, chamada relação de dispersão, é muito diferente quer da de um eletrão livre, quer da da maior parte dos materiais (metais, semicondutores ou isoladores):
- As bandas não se sobrepõem em energia, mas o gap é nulo; o topo da de valência e a base da de condução coincidem. Podemos excitar eletrões da banda de valência para a de condução sem custo de energia. Por esta razão o grafeno é um semi-metal.
- Próximo da energia onde as bandas se tocam, os estados electrónicos têm a seguinte relação entre energia e momento*:
\[E\left( p \right) = \pm {v_F}p\]
(+ para os estados de condução e − para os de valência; energia medida em relação ao estado em que as bandas se tocam).
Esta dependência linear entre energia e momento é a mesma que a de um fotão. Com efeito, das relações de Einstein, \(E = h\upsilon \), e de de Broglie, \(p = h/\lambda \) resulta \(E\left( p \right) = cp\) (para a luz \(c = \lambda \upsilon \)). Isto significa que para os estados eletrónicos que correspondem a excitações de baixa energia, os eletrões do grafeno são partículas sem massa, que se movem com uma velocidade fixa, vF, independente da sua energia (vF é cerca de 300 vezes inferior à velocidade da luz). O grafeno é afinal um laboratório para estudar efeitos relativistas em duas dimensões, sem qualquer acelerador!
Esta situação, que resulta muito naturalmente do tipo de rede cristalina do grafeno (rede hexagonal e planar), foi uma novidade completa em Física dos materiais, e estimulou muitos trabalhos teóricos, que revelaram surpresa atrás de surpresa, nas propriedades elétricas e óticas deste material†. Por exemplo, como foi referido acima, a absorção de luz na gama do visível é quase independente da frequência e tem um valor determinado apenas por constantes fundamentais: a carga do electrão, a constante de Planck e a velocidade da luz. A combinação desta transparência com a capacidade de sustentar correntes eléctricas muito elevadas, como os metais, é outra associação muito invulgar. Se reparar nos espelhos que tem em casa, notará que na face interior do vidro têm uma camada muito fina de metal; ela é suficiente para reflectir quase totalmente a luz incidente; os bons condutores, como a prata, têm uma reflectividade próxima de 100 % em boa parte da gama do visível. Ser transparente e condutor é mais uma das características raras do grafeno, que o torna muito promissor como material, seja para ecrans (displays)—daí o interesse de especialistas como a Samsung—seja como eléctrodo em células solares.
O grafeno tem a maior razão superfície/volume que um material pode ter: é todo superfície. Adsorve vários tipos de moléculas com facilidade, e a variação das suas propriedades eléctricas com a adsorção de uma única molécula é mensurável: a última palavra em sensores químicos.
Cortando folhas de grafeno em pedaços de dimensões da ordem do nanómetro, criamos nano-partículas, às quais facilmente colamos moléculas que nos interessem. Uma aplicação na área da saúde consiste em usar pequenas folhas de grafeno para levar moléculas fluorescentes até tumores, para permitir a sua localização ótica.
Embora como membrana seja essencialmente impermeável a tudo, é possível perfurar no grafeno—com um feixe de electrões de elevada energia, por exemplo—buracos de dimensão controlável para construir toda a espécie de filtros. Uma aplicação fascinante consiste em passar moléculas de ADN num nanoporo de uma membrana de grafeno. Em princípio, a variação da condutividade iónica através do nano-poro depende das moléculas que o ocupam. No caso de um nanoporo em grafeno, em cada instante, um único par de bases do ADN ocupa o poro, dada a espessura atómica da membrana. A esperança é que seja eventualmente possível saber quais as bases que passam no nanoporo, em cada momento, e por essa via ler a sequência de bases de uma amostra de ADN, com muita rapidez e baixo custo.
Mais recentemente, o interesse dos investigadores tem-se alargado a outros materiais, sejam derivados do grafeno como o óxido de grafeno, sejam outros materiais bi-dimensionais. Um exemplo, vindo do grupo de Manchester, é o de agregados de membranas de óxido de grafeno. Este material é extremamente poroso à água, mas, surpreendentemente, impermeável a qualquer gás, incluindo hélio! Aparentemente, as moléculas de água conseguem escoar em forma de uma mono-camada molecular entre as camadas de grafeno; ou estas mono-camadas bloqueiam a passagem de outas moléculas e átomos, ou, na ausência de água, estes canais estreitam e fecham. Seja como for, moléculas de água difundem através destas membranas 1010 vezes mais depressa que átomos de Hélio. Talvez um dia o(a) leitor(a) possa comprar uma garrafa termos com filtros de óxido de grafeno, que possa encher por um lado com água do mar, para beber, já dessalinizada, pelo outro.
Estes exemplos ilustram a comparação feita acima com a descoberta do alicate. A partir de 2004 descobrimos que era possível dispor de um novo tipo de ferramenta: uma membrana, de espessura atómica, diáfana, mas extremamente robusta, e facilmente manipulável, física e quimicamente. Que mais pode um cientista ou engenheiro de materiais querer?
Num artigo, muito acessível, publicado na revista Nature em 20125, Novoselov, Falko, da Universidade de Lancaster, e investigadores das companhias Texas Instruments, BASF e Samsung, discutem uma extensa lista de aplicações possíveis do grafeno, de materiais dele derivados, ou de outros materiais bi-dimensionais. A lista inclui a electrónica, a fotónica—fontes, moduladores de luz ou mesmo de radiação no Thz, uma gama do espectro electromagnético tecnologicamente difícil de explorar—, tintas e revestimentos, geração e armazenamento de energia, sensores e aplicações biológicas.
Estas aplicações estão em diferentes estados de desenvolvimento, mas a inovação tem ocorrido a uma tal velocidade, ultrapassando as expectativas mais optimistas, que é seguro prever que não passará muito tempo até vermos produtos no mercado baseados no grafeno. Por outro lado, o potencial é tal, que é também de esperar que a inovação e desenvolvimento de produtos baseados em grafeno e materiais semelhantes vá continuar durante muitos anos.
Termino sugerindo dois artigos de divulgação escritos por alguns dos cientistas que mais contribuíram para o nosso conhecimento deste notável material:
- Drawing conclusions from Graphene, de Antonio Castro Neto, Francisco Guinea e Nuno Peres6;
- Graphene: Status and Prospects de Andre Geim7.
Notas do autor
- Em rigor, é o “excesso” de momento relativo ao valor para o qual as bandas se tocam.
- Um dos físicos que mais se distinguiu no desenvolvimento da teoria do grafeno foi o português Nuno Peres, docente da Universidade do Minho.
Referências
- 1 Pauling, L. The Nature of the Chemical Bond, 3rd edition. NY : s.n., 1960.
- 2 Ozyilmaz, Barbaros. Making graphene 101, Ozyilmaz’ Group. [Online] https://www.youtube.com/watch?v=rphiCdR68TE
- 3 Dumé, Belle. Physics World. [Online] 2014. http://physicsworld.com/cws/article/news/2008/jul/17/graphene-has-record-breaking-strength
- 4 Yarris, Lynn. Berkeley Lab News Center. [Online] 2012. http://newscenter.lbl.gov/featurestories/2012/04/19/.
- 5 A Roadmap for Graphene. K., Novoselov e et. al. 2012, Nature, Vol. 490, pp. 192-200
- 6 Drawing conclusions from Graphene. Castro Neto, A, Guinea, F e Peres, N. 2006, Physics World, pp. 33-37
- 7 Graphene: status and prospects. Geim, A. 2009, Science, pp. 1530-1534
Este artigo já foi visualizado 8560 vezes.



