Diamante
📧
- Faculdade de Ciências da Universidade do Porto
Referência Ribeiro, D., (2014) Diamante, Rev. Ciência Elem., V2(2):175
DOI http://doi.org/10.24927/rce2014.175
Palavras-chave Diamante; alotrópicas; elemento; químico; carbono; amorfo; grafite; diamante;
Resumo
O diamante é uma das formas alotrópicas do elemento químico carbono. O carbono pode ser encontrado na Natureza em três diferentes formas simples: amorfo, grafite e diamante.1
A grafite é a forma estável do carbono a 1 atm e 25 ºC, mas a velocidade do processo espontâneo: C (diamante) → C (grafite), a esta pressão e temperatura é extremamente lenta. São necessários milhões de anos para que o diamante se transforme em grafite.
O diamante natural formou-se no interior da Terra a partir de grafite sujeita a pressões enormes durante milhões de anos. A estrutura do diamante revela-se termodinamicamente estável a pressões superiores a 6 GPa, à temperatura ambiente. No entanto, quando submetido a pressões idênticas à pressão atmosférica, o diamante passa a encontrar-se num estado metastável – um estado de equilíbrio estável diferente do equilíbrio termodinâmico. A baixas pressões o diamante converte-se rapidamente em grafite, para temperaturas acima de 1900 K, em atmosferas inertes.2
De todas as pedras preciosas, os diamantes são as de valor mais elevado. Historicamente, o diamante era um símbolo de força, coragem e invencibilidade.3 Os registos existentes de exploração de diamantes datam de há mais de 4000 anos. Nessa altura, e desde então, esses cristais têm sido utilizados como decorações de peças religiosas ou como talismãs. Acredita-se que foi Alexandre, o Grande, que, no século IV a.C., trouxe os primeiros diamantes para a Europa.3 Até ao século XVIII, a Índia era, quase exclusivamente, o único país onde a extração deste material era feita. Posteriormente, também se encontraram reservas de diamantes, primeiro no Brasil e depois na África do Sul. A partir do século XX, a África do Sul e outros países africanos assumiram-se como os principais exportadores mundiais de diamantes.
As propriedades físicas do diamante fazem deste um material extremamente atrativo. É o material mais duro conhecido até à data e, por isso, figura no máximo da escala de Mohs – escala que compara a dureza dos materiais; o diamante possui classificação 10 nessa escala. Além de duro, este material possui uma condutividade elétrica muito baixa. Este último facto deve-se à estrutura cristalina do diamante4 – cúbica (ver figura 1) – e ao tipo de ligação química4 existente entre os átomos de carbono no mesmo – covalente com hibridização sp3.
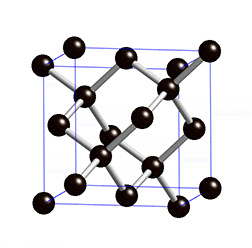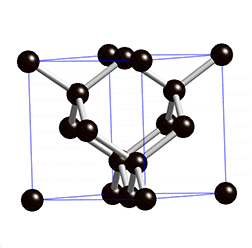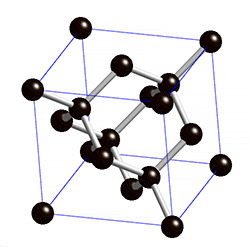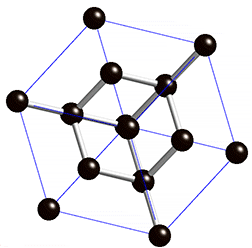
Além disto, o diamante possui uma condutividade térmica invulgarmente elevada para um material não metálico. É opticamente transparente para a radiação visível e algumas regiões do infravermelho e possui um elevado índice de refração.
Alguns diamantes são utilizados na indústria como ferramentas de corte. Nesse sentido, foram elaboradas técnicas de produção de diamantes sintéticos na década de 19504, submetendo a grafite a pressões e temperaturas muito elevadas. Nos últimos anos, a tecnologia de produção de diamantes sintéticos permitiu ao Homem produzir finas placas de diamante (de cerca de 1 mm de espessura) que possuem propriedades bastante próximas das do diamante de dimensões regulares.4 Isto possibilitou o revestimento de lâminas, brocas e serras para melhorar a sua capacidade de corte ou perfuração.
Referências
- 1 D. R. Lide, ed., CRC Handbook of Chemistry and Physics, 89th edition, Boca Raton, Fla. London: CRC, 2008, ISBN: 978-1420066791.
- 2 IUPAC Gold Book: Diamond, consultado em 15/11/2011. (http://goldbook.iupac.org/PDF/D01671.pdf).
- 3 M. Dundek, Diamonds, 3rd edition, London: Noble Gems, 2009, ISBN: 978-0-9537884-3-9.
- 4 W. Callister, Materials Science and Engineering: An Introduction, Interactive MSE, 4th edition, New York: John Wiley & Sons, 1997, ISBN: 978-0-471-16867-6.
- 5 Wikimedia Commons: Diamond Cubic-F lattice animation, consultado em 15/11/2011 (http://upload.wikimedia.org/wikipedia/commons/2/22/Diamond_Cubic-F_lattice_animation.gif)
Este artigo já foi visualizado 4547 vezes.



