Número atómico
📧
- Faculdade de Ciências da Universidade do Porto
Referência Ribeiro, D., (2014) Número atómico, Rev. Ciência Elem., V2(2):181
DOI http://doi.org/10.24927/rce2014.181
Palavras-chave Número; atómico; protões; núcleo; elementos; químicos; Tabela; Periódica;
Resumo
O número atómico, Z, é o número de protões do núcleo atómico.1 O símbolo atribuído, Z, deve-se à palavra alemã “Zahl” que significa “número” correspondendo ao número de ordem dos elementos químicos na Tabela Periódica.2
O número atómico identifica inequivocamente um elemento
químico. Átomos com o mesmo número atómico mas com diferente número de
neutrões, N, – isótopos – diferenciam-se pelo número
de massa, A, número de nucleões (protões e neutrões) no
respetivo núcleo atómico, sendo
O número atómico é indicado como índice inferior (subscript) do lado esquerdo do símbolo do elemento químico correspondente.4,5 Por exemplo, a notação \({}_{9}^{18}\!\text{ F}\) representa um átomo de flúor com A = 19 e Z = 9. Isto significa que este átomo possui 9 protões (número atómico), 19 nucleões (número de massa) e, portanto, 10 neutrões.6
A descoberta do número atómico resultou inicialmente do trabalho do advogado e cientista amador Antonius van den Broek (1870–1926). Em 1912, van den Broek concluiu, um mês após a proposição do modelo planetário do átomo por Ernest Rutherford (1971–1937), que o número total de eletrões num átomo corresponde à sua posição ordinal na tabela de Dmitri Mendeleev (1834 – 1907) e que esse número teria que corresponder ao número de protões.7
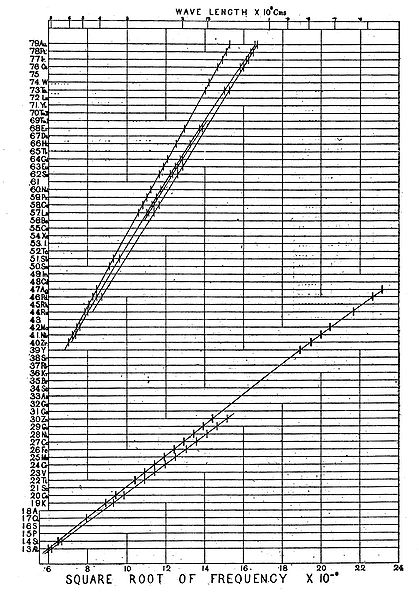
Menos de um ano depois, em 1913, o físico inglês Henry Moseley (1887–1915) fez incidir raios X sobre amostras de diferentes elementos, e mediu as frequências das radiações refletidas, verificando que a raiz quadrada da frequência variava linearmente com o número de protões (ver figura 1).8,9 Estes estudos permitiram atribuir um conceito formal ao número atómico.
A descoberta de Moseley possibilitou uma nova visão sobre a Tabela Periódica. A ordenação com base no número atómico (número de protões) permitiu sanar as pseudo-irregularidades constatadas por Mendeleev – inversão de posições entre telúrio e iodo, por exemplo – que usou a massa atómica como base sequencial da primitiva Tabela Periódica.9,10 Além disso, esta descoberta proporcionou a previsão da existência de novos elementos (ver figura 1), como o Promécio, 61Pm, só descoberto em 1947.9,11
Referências
- 1 IUPAC Gold Book: Atomic Number, consultado em 30/03/2011.
- 2 Why is atomic number called "Z", consultado em 30/03/2011.
- 3 IUPAC Gold Book: Mass Number, consultado em 30/03/2011.
- 4 Elemental Notation and Isotopes, consultado em 30/03/2011.
- 5 Quím. Nova vol.22 n.5 São Paulo Sept./Oct. 1999, consultado em 30/03/2011.
- 6 N. G. Connelly, T. Damhus, R. M. Hartshorn, A. T. Hutton, Nomenclature of Inorganic Chemistry – IUPAC Recommendations 2005, Royal Society of Chemistry, Cambridge, UK, 2005, ISBN: 0-85404-438-8, p. 47, consultado em 30/03/2011.
- 7 W. R. Shea, Otto Hahn and the rise of nuclear physics, Reidel, Dordrecht-Boston-Lancaster, p. 19 – 21, consultado em 30/03/2011.
- 8 The High-Frequency Spectra of the Elements, consultado em 30/03/2011.
- 9 J. L. Heilbron, The Work of H. G. J. Moseley, Ísis, vol. 57, no. 3 (Autumn, 1996), pp. 336-364.
- 10 Atomic Number, consultado em 30/03/2011.
- 11 Separation of Rare Earth Elements, consultado em 30/03/2011.
Este artigo já foi visualizado 11544 vezes.



