Ponto de Fusão
📧
- Instituto Tecnológico e Nuclear
Referência Leal, J.P., (2014) Ponto de Fusão, Rev. Ciência Elem., V2(2):183
DOI http://doi.org/10.24927/rce2014.183
Palavras-chave Fusão; temperatura; sólido; líquido; substância; congelação; cristalização;
Resumo
Ponto de fusão é a temperatura à qual se dá a passagem do estado sólido ao estado líquido. O ponto de fusão de uma substância depende (embora pouco) da pressão e é usualmente especificado para condições padrão de pressão. Quando se refere a passagem do estado líquido para o estado sólido utilizam-se as designações de ponto de congelação ou de cristalização.1
Para sólidos puros, durante o processo de fusão a temperatura do sistema sólido-líquido mantém-se constante (Figura 1). O caso mais conhecido é o do gelo (água sólida) em que a temperatura se mantém a 0 °C durante todo o processo de fusão à pressão padrão de 1 bar (105 Pa), independentemente de existir muito ou pouco gelo em equilíbrio com a água líquida.
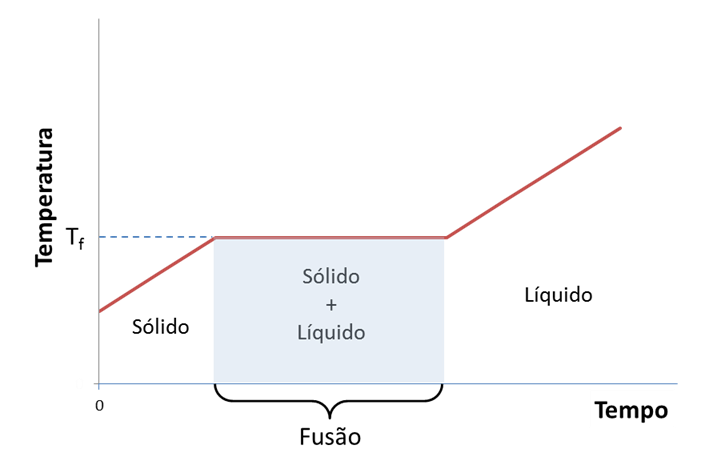
Na tabela 1 apresentam-se os pontos de ebulição de algumas substâncias.
| Substância | Fórmula | Tf/K | Tf/ºC |
|---|---|---|---|
| Etanol | C2H5OH | 161,2 | -112,0 |
| Água | H2O | 273,1 | 0,0 |
| Benzeno | C6H6 | 278,6 | 5,5 |
| Fenol | C6H5OH | 313,8 | 40,6 |
| Naftaleno | C10H8 | 353,4 | 80,2 |
| Sódio | Na | 370,8 | 97,7 |
| Chumbo | Pb | 600,1 | 327,0 |
| Ferro | Fe | 1808,1 | 1535,0 |
Ao contrário que se verifica para substâncias puras, na grande maioria das misturas as temperaturas de fusão não se mantêm constantes ao longo da transformação (Figura 2). Verifica-se, também, que nestes casos existe separação dos componentes da mistura durante a mudança de fase. Para as misturas, as mudanças de estado físico ocorrem em intervalos de temperatura.2
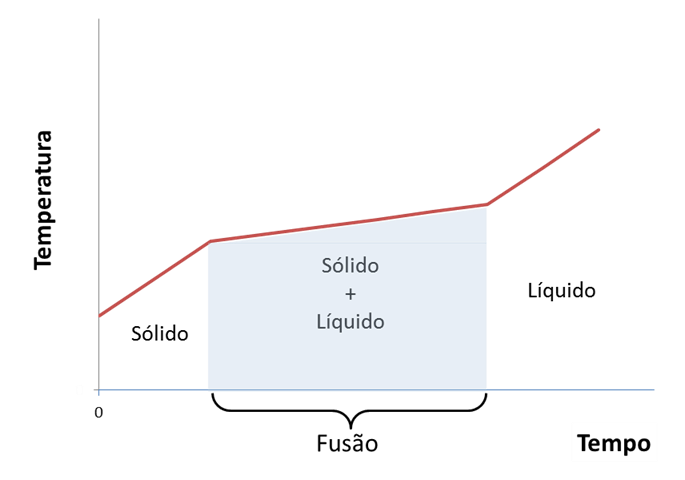
Para misturas sólidas conhecidas como misturas eutéticas, misturas de duas ou mais substâncias em proporções tais que a mistura se comporta como uma substância pura, isto é, a temperatura de fusão é, constante durante todo o processo e não existe separação dos componentes da mistura. Como exemplo de uma mistura eutética podemos referir a solda utilizada para soldar componentes em circuitos electrónicos (mistura de chumbo e estanho na proporção aproximada de 60/40%).
Existem ainda substâncias que têm a capacidade de sobrearrefecer, i.e. manterem-se líquidas abaixo do seu ponto de congelação. Este estado que é termodinamicamente instável (metaestável) evoluirá, mais depressa ou mais devagar, dependendo de condições externas, para o estado mais estável.
Referências
- 1 A. Pires de Matos, I. Santos, J. P.Leal, J. Marçalo, N. Marques, R. T. Henriques, Química: Princípios e Aplicações, Ed. Fundação Calouste Gulbenkian, Lisboa, (2ª ed.), 2010; p.515-516.
- 2 M. E. Arieiro, C. Corrêa, F. P. Basto e N. Almeida, Preparação para o Exame Nacional Física e Química A, Porto: Porto Editora, 2012; ISBN 978-972-0-01669-0
Este artigo já foi visualizado 13346 vezes.



