Equilíbrio químico
📧
- Faculdade de Ciências da Universidade do Porto
Referência Fernandes, R.F., (2015) Equilíbrio químico, Rev. Ciência Elem., V3(2):034
DOI http://doi.org/10.24927/rce2015.034
Palavras-chave Equilíbrio; químico;
Resumo
Uma reação química reversível atinge o estado de equilíbrio após um determinado intervalo de tempo reacional, a partir do qual as concentrações ou as pressões parciais dos reagentes e dos produtos de reação se mantêm constantes ao longo do tempo e as velocidades de reação no sentido direto e inverso são iguais (Figura 1).
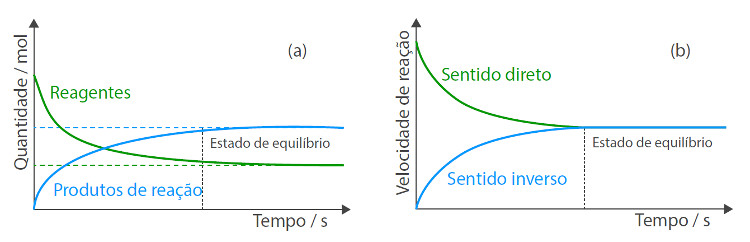
Numa reação química reversível, o estado de equilíbrio é atingido quer a partir dos reagentes quer a partir dos produtos de reação. À medida que se formam as primeiras partículas de produto de reação, estas combinam-se entre si voltando a originar os reagentes iniciais. Por outro lado, partindo dos produtos de reação ocorre o processo inverso, após um determinado intervalo de tempo, as velocidades de reação nos sentidos direto e inverso são iguais, atingindo-se um estado de equilíbrio químico.
Assim, a composição do sistema mantém-se inalterada e as propriedades macroscópicas do sistema (cor, pressão, concentrações, temperatura e volume) não variam ao longo do tempo. Macroscopicamente, o equilíbrio químico é estático, porém, a nível microscópico a reação prossegue em ambos os sentidos, estando-se assim na presença de um equilíbrio dinâmico.
Na representação simbólica dos sistemas em equilíbrio químico, utiliza-se o símbolo ⇌ que indica que o sistema se encontra em equilíbrio. Por exemplo, a seguinte equação:
\( H_2(g) + I_2(g) \rightleftharpoons 2HI(g)\)
traduz o equilíbrio, em fase gasosa, estabelecido entre o hidrogénio molecular (H2) e o iodo molecular (I2) com o iodeto de hidrogénio (HI).
O equilíbrio químico é classificado como homogéneo ou heterogéneo de acordo com número de fases envolvidas. Para sistemas cujos constituintes se encontram todos numa única fase o equilíbrio é designado por equilíbrio homogéneo. Nos sistemas em que os constituintes se encontram distribuídos em várias fases o equilíbrio é classificado como equilíbrio heterogéneo.
O equilíbrio químico começou a ser estudado em 1798, pelo químico francês Claude Louis Berthollet enquanto acompanhava Napoleão Bonaparte numa expedição ao Egito. Quando estudava alguns lagos de água salgada egípcios, Berthollet observou nas margens a presença de depósitos de carbonato de sódio (Na2CO3). O químico francês que já estava familiarizado com o composto (Na2CO3) através de uma reação sua conhecida, traduzida pela seguinte equação química:
\(Na_2CO_3+CaCl_2 \rightarrow CaCO_3+ 2NaCl\)
propôs que o carbonato de sódio (Na2CO3) se teria sido formado através da inversão da reação anterior, provocada pela elevada concentração de NaCl e de CaCO3 resultante da lenta evaporação da água do lago. Berthollet viria a publicar, em 1803, estas observações no livro Essai de Statique Chimique, porpondo que se os produtos de reação se encontrassem presentes em concentrações elevadas as reações poderiam ocorrer em sentido inverso.
Posteriormente, baseados no trabalho de Berthollet os químicos noruegueses Cato Guldberg e Peter Waage publicaram, em 1864, a lei de ação de massas que é algebricamente traduzida por uma equação denominada constante de equilíbrio que caracteriza quantitativamente o equilíbrio químico.
No decurso dos estudos dos sistemas em equilíbrio, o físico e químico francês Henry Le Châtelier e o físico alemão Karl Ferdinand Braun, descobriram de modo independente, o que atualmente é conhecido como princípio de Le Châtelier. Estes cientistas demonstraram que quando se provoca uma perturbação num sistema em equilíbrio (alteração da temperatura, da concentração ou da pressão, entre outros) o equilíbrio desloca-se no sentido de contrariar essa alteração, até atingir um novo estado de equilíbrio.
No quotidiano, o equilíbrio químico está presente em várias situações, desde processos bioquímicos a processos industriais. A nível bioquímico um exemplo bastante conhecido que ocorre no organismo humano, aquando das trocas gasosas nos alvéolos pulmonares, corresponde ao equilíbrio estabelecido entre a hemoglobina (Hb) (proteína responsável pelo transporte do oxigénio até às células) o oxigénio molecular (O2) e a oxi-hemoglobina (Hb(O2)4). A equação seguinte traduz o equilíbrio estabelecido:
\( Hb(aq)+4O_2(g) \rightleftharpoons Hb(O_2)_4(aq)\)
À altitude do nível da água do mar, a pressão parcial de oxigénio na atmosfera é suficiente para manter o equilíbrio anterior sem que se tenha qualquer sintoma de hipoxia (baixo teor de oxigénio no sangue). Porém, a altitudes elevadas o oxigénio encontra-se a uma menor pressão parcial na atmosfera, o que de acordo com o princípio de Le Chateliêr leva a que o equilíbrio se desloque para a esquerda. Como resultado desta resposta, a concentração de oxi-hemoglobina (Hb(O2)4) diminui, consequentemente a quantidade de oxigénio transportado para as células é menor, provocando hipoxia que apresenta como sintomas: náuseas, vómitos, dores de cabeça ou fadiga.
Um dos mecanismos de resposta do organismo é produzir hemoglobina de modo deslocar o equilíbrio no sentido de produzir oxi-hemoglobina. É por este motivo que os alpinistas quando escalam montanhas de elevadas altitudes necessitam de um intervalo de tempo de adaptação para que o organismo produza mais hemoglobina.
O equilíbrio químico é também importante a nível industrial, dado que quando se projeta um determinado processo como, por exemplo, a síntese a grande escala de um medicamento, tem de se conseguir uma reação tão completa quanto possível de modo a maximizar a produção do composto pretendido. Um dos casos mais conhecidos a nível industrial é o processo da síntese do amoníaco (NH3), vulgarmente designado como o processo Haber-Bosh.
Referências
- 1 http://www.chem1.com/acad/webtext/chemeq/Eq-01.html, consultado em 08/05/2012.
- 2 http://www.chemwiki.ucdavis.edu/Physical_Chemistry/Chemical_Equilibrium/Characteristics_Of_The_Equilibrium_State, consultado em 08/05/2012.
- 3 http://nobelprize.org/nobel_prizes/chemistry/laureates/1918/, consultado em 08/05/2012.
Este artigo já foi visualizado 8982 vezes.