Vírus de laboratório
📧
- DN/ VIB/ KU Leuven
Referência Calafate, S., (2021) Vírus de laboratório, Rev. Ciência Elem., V9(2):031
DOI http://doi.org/10.24927/rce2021.031
Palavras-chave Genes, Virus, Terapia genetica
Resumo
Quando falamos em vírus, é provável que as primeiras memórias que lhe vêm ao pensamento sejam o vírus Ébola, o vírus Influenza A do subtipo H1N1, ou mais provavelmente o vírus da COVID-19. O que estes vírus têm em comum é o facto de terem ameaçado a nossa sociedade. Mas serão todos os vírus “maus”? A verdade é que existem vírus que têm um papel muito importante na investigação e, para além disso, podem ajudar a curar doenças genéticas. Neste artigo, irei descrever alguns exemplos que mostram que os vírus são ferramentas essenciais na investigação e na medicina. Desta forma, pretendo sensibilizar o leitor para a importância dos vírus e, assim, transformar o estigma negativo existente para com os vírus.
O cenário que se vive no mundo desde o início do ano de 2020 devido ao surto causado pelo coronavírus ficará, certamente, gravado na memória de todos nós. Ainda há relativamente pouco tempo, em 2009, vivemos uma outra pandemia provocada pelo vírus da gripe A. O coronavírus não será, muito certamente, o último vírus a espalhar-se pelo mundo. Devido a este cenário, os vírus são inevitavelmente associados a sentimentos negativos pois causam surtos epidémicos e pandemias que assolam, periodicamente, a humanidade. No entanto, a utilização de vírus como ferramentas para combater doenças genéticas tem um enorme potencial. É, portanto, crucial, que a investigação fundamental acerca da biologia dos vírus continue e, assim, possamos tirar o máximo partido destes organismos como veículos de entrega de material genético com diferentes finalidades.
Os avanços na área da biologia molecular, por volta da década de 80, tornaram possível editar o genoma de organismos procarióticos, permitindo a inserção de genes provenientes de outros genomas como, por exemplo, de mamíferos. Este método, denominado de clonagem de genes, origina uma molécula de DNA recombinante, a qual é posteriormente amplificada pelo organismo hospedeiro. Com o aperfeiçoamento das técnicas de clonagem, a capacidade de manipular o genoma dos vírus emergiu1. Como os vírus têm a capacidade de infetar diversos tecidos e transferir o seu material genético para as células hospedeiras podemos, desta forma, combinar o conhecimento da biologia dos vírus com os avanços de clonagem e utilizá-los como vetores para a transferência de genes entre organismos. A aplicabilidade destas ferramentas é vasta, sendo comum utilizar vetores virais para induzir ou eliminar a expressão de determinados genes em tecidos específicos de diferentes organismos. No entanto, a aplicação mais promissora dos vetores virais é a sua utilização na terapia de doenças genéticas.
Os vírus de laboratório
O espectro de vírus utilizados em laboratório é enorme. Alguns exemplos destes são o adenovírus, vírus associado a adenovírus (adeno-associated virus - AAV), vírus herpes simplex (HSV), retrovírus, lentivírus ou, até mesmo, o vírus da raiva. Em todos estes casos, os vírus utilizados em laboratório são modificados de forma a que todo o processo esteja sobre o controlo do investigador e de forma a que não causem uma resposta imunitária no sistema que recebe o vírus. A escolha do vetor viral é importante pois os diferentes tipos têm as suas vantagens e desvantagens. Alguns dos aspetos a ter em atenção são a durabilidade do efeito desejado (curta ou longa duração), a capacidade de armazenamento de informação dos vírus (quantos genes podem transportar) ou a forma como o vírus se replica, pois há vírus que contêm material genético na forma de DNA ou RNA e estes podem estar organizados em cadeias simples ou duplas2.
Os AAV são, neste momento, o vetor viral mais utilizado em investigação fundamental e, até mesmo, com mais sucesso na área da terapia genética. A utilização deste vetor viral permite a expressão de longa duração dos genes transferidos para o tecido hospedeiro. Para além disto, diferentes estirpes de AAVs infetam diferentes tecidos. A característica mais importante dos AAVs é terem um perfil imunogénico baixo e, desta forma, não desencadearem fortes respostas no hospedeiro. Com o aumento da utilização desta ferramenta, os AAV foram-se tornando extremamente versáteis. Para além da utilização de estirpes naturais, surgiram também uma série de estirpes quiméricas, criadas em laboratório, onde a cápside do vírus está manipulada a fim de melhorar a sua capacidade de infetar novos tecidos como é o caso do sistema nervoso. Por outro lado, os protocolos de produção destes vírus têm sido otimizados podendo agora produzir-se quantidades em grande escala3, 4.
Os AAV na investigação fundamental
No caso da investigação fundamental em neurociências, podemos tirar partido destes vetores para estudar os processos que vão desde o desenvolvimento de neurónios até à função destes num circuito neuronal. Uma das formas utilizadas é através da “marcação” dos neurónios de interesse, no cérebro do animal usado como modelo de estudo, sendo o murganho e o rato os modelos mais utilizados. Uma das estratégias mais comum com este propósito é a expressão de genes repórter no tipo de neurónios em estudo, como é o caso do gene que codifica para a proteína verde fluorescente - GFP (Green Fluorescent Protein). Por exemplo, podemos modificar o genoma do AAV de forma a expressar a GFP sob o controlo de um promotor que é ativo apenas num certo tipo de neurónios, permitindo monitorizar esta população de neurónios ao longo do tempo (FIGURA 1).
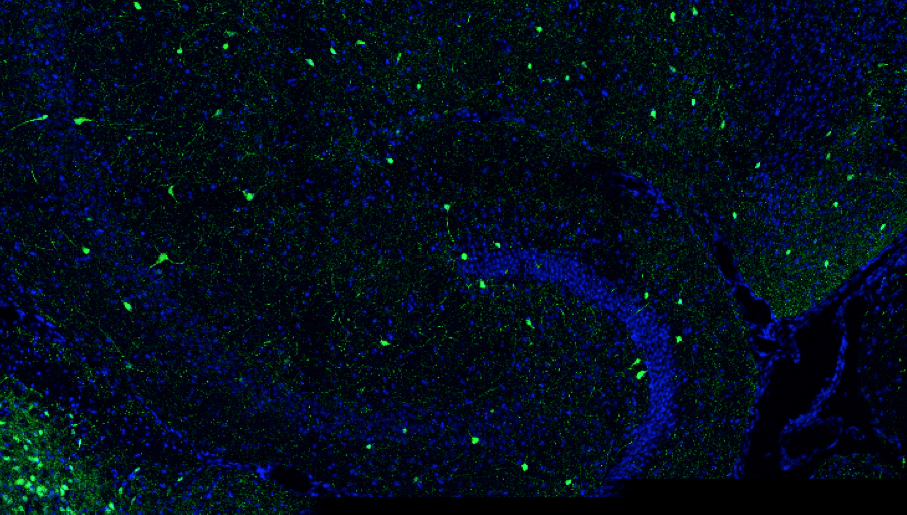
Com o objetivo de estudar a função de um certo tipo de neurónios, o investigador pode também, expressar nos neurónios de interesse proteínas que formam canais iónicos nas membranas celulares e que interferem, aumentando ou diminuindo, a atividade neuronal5.
É possível também estudar a função de um gene envolvido numa doença neurodegenerativa. Para tal, podemos infetar neurónios com um AAV que transporta a forma normal do gene humano envolvido nesta doença e, depois, comparar os efeitos com os de neurónios infetados com o gene contendo uma mutação relevante para o quadro clínico dos doentes. Utilizando esta estratégia, é possível perceber se mutações neste gene induzem alterações na função dos neurónios e, assim, desvendar os mecanismos moleculares envolvidos no processo de neurodegeneração6.
Terapia genética utilizando vetores virais
Algumas doenças são causadas por mutações num único gene. A terapia viral genética com retrovírus foi já usada com sucesso algumas décadas atrás no tratamento de imunodeficiência combinada severa (Severe Combined Immunodeficiency - SCID) em crianças2. No entanto, a falta de experiência no desenho e planeamento deste tipo de intervenção, levou a que os doentes desenvolvessem efeitos secundários do foro oncológico. Esta situação aumentou o ceticismo em relação à terapia viral genética. Contudo, modificações inovadoras nesta área fizeram com que a terapia viral genética renascesse e em 2012 decorriam já 1843 ensaios clínicos envolvendo 31 países. O principal obstáculo destes ensaios é a baixa eficiência dos vetores virais, sendo o número de células infetadas bastante reduzido, comprometendo a eficiência dos tratamentos. Dentro dos ensaios mais recentes, os que tiveram mais sucesso foram os direcionados para a distrofia da retina, diferentes tipos de imunodeficiência, hemofilia B14 e adrenoleucodistrofia associada ao cromossoma X (X-ALD)7. A utilização de lentivírus no tratamento de X-ALD, uma doença em que a desmielinização no sistema nervoso central ocorre, foi o primeiro caso de uma terapia para uma doença severa do sistema nervoso a apresentar resultados positivos. Atualmente, os AAV são os vetores virais com mais potencial para este fim. Dentro dos AAV, a estirpe AAV2 é a mais estudada e faz parte do primeiro programa aprovado pela agência Americana Food and Drug Administration (FDA) na cura da distrofia da retina hereditária, utilizando AAVs2, 7. Neste programa, já em fase 3, pretende-se substituir o gene RPE65 mutado por uma versão normal do gene. Os resultados obtidos na fase 1 do ensaio clínico são promissores, mostrando a recuperação da visão dos pacientes tratados e a ausência de respostas imunitárias ao vetor viral utilizado. De grande interesse são também os AAV recombinantes utilizando a cápside da estirpe 9 – AAV9 – que têm sido utilizados para combater condições neurológicas como a atrofia muscular espinhal. Os ensaios mostram também resultados preliminares positivos, sugerindo que estes vetores conseguem penetrar a barreira hematoencefálica em seres humanos.
Em termos de conclusão, todos estes ensaios apontam a terapia genética, utilizando vetores virais, como sendo relativamente segura e bastante promissora no tratamento e, até mesmo, na cura de doenças genéticas.
Referências
- 1 FLOTTE, T. R., Gene therapy: The first two decades and the current state-of-the-art, J. Cell. Physiol. 213, 301–305. 2007.
- 2 LUNDSTROM, K., Viral Vectors in Gene Therapy, Diseases 6, 42. 2018.
- 3 POTTER, M. et al., A simplified purification protocol for recombinant adeno-associated virus vectors, Mol. Ther. - Methods Clin. Dev. 1, 14034. 2014.
- 4 HUANG, X. et al. AAV2 production with optimized N/P ratio and PEI-mediated transfection results in low toxicity and high titer for in vitro and in vivo applications, J. Virol. Methods 193, 270–277. 2013.
- 5 ROTH, B. L., DREADDs for Neuroscientists, Neuron, 89, 683–694. 2016.
- 6 CALAFATE, S. et al., Synaptic Contacts Enhance Cell-to-Cell Tau Pathology Propagation, Cell Rep. 11. 2015.
- 7 GINN, S. L. et al., Gene therapy clinical trials worldwide to 2017: An update, J. Gene Med. 20, 1–16. 2018.
Este artigo já foi visualizado 3231 vezes.



