Cianobactérias
📧
- CITAB/ DeBA/ UTAD
Referência Sampaio, A. C., (2022) Cianobactérias, Rev. Ciência Elem., V10(2):022
DOI http://doi.org/10.24927/rce2022.022
Palavras-chave teoria endossimbiôntica; evolução; Cianobactérias; endossimbiose primária; plastídios
Resumo
Há cerca de 2,0 x 109 anos surgiram os primeiros Eucariotas. A teoria Endossimbiótica, formalmente apresentada pela microbióloga Lynn Margulis, postula que os Eucariotas atuais se formaram a partir de endossimbioses com bactérias, que permaneceram no interior das células ao longo do tempo, originando as mitocôndrias e cloroplastos — estes últimos há pelo menos 1,5 x 109. A descoberta de outra endossimbiose primária mais recente (90 milhões de anos) envolvendo uma cianobactéria similar a Synechococcus e o cercozoário Paulinella sp., e de outras associações de vários tipos envolvendo cianobactérias, além de mostrarem a sua capacidade de associação a uma elevada diversidade de hospedeiros filogeneticamente muito distantes, levantam importantes questões.
Em 1883 Andreas Schimper foi um dos primeiros a estudar e a descrever a potencial natureza endossimbiótica das células eucarióticas, após ter reparado que a divisão dos cloroplastos nas plantas era parecida com a das Cianobactérias de vida livre. No início do século XX, em 1905, Konstantin Mereschkowsky sugeriu a ideia da origem endossimbiótica dos plastídios. Em 1927, e em conjunto com Ivan Wallin, sugeriu que a célula eucariota era composta por microrganismos, hipótese rejeitada pela comunidade científica. Foram precisos quarenta anos para, em 1967, Lynn Margulis (1938-2011) recuperar essa hipótese arrojada e dar-lhe respeitabilidade científica12. Esse hiato de tempo deveu-se não só à inércia face a uma ideia completamente revolucionária, mas também a limitações técnicas que não permitiam saber algumas características importantes de cloroplastos e mitocôndrias como a presença de ácidos nucleicos, de duas membranas com composições distintas e de ribossomas 70S. A invenção do microscópio eletrónico permitiu descobertas importantes nos anos 60 do século XX, entre elas a descoberta de DNA nos cloroplastos de Chlamydomonas moewusii (Ris e Plaut, em 1962) e nas mitocôndrias, (Margit Nass e Sylvan Nass em 1963-1964). Neste último caso, a descoberta foi corroborada por análises bioquímicas pelos investigadores Ellen Haslbrunner, Hans Tuppy e Gottfried Schatz3, 6.
Na atualidade, existem muitos factos que apoiam a teoria endossimbiótica na origem desses dois organelos celulares, sendo do consenso geral que mitocôndrias e cloroplastos tiveram origem, respetivamente, em ancestrais das bactérias \(\alpha\)-púrpura (primeiro evento de endossimbiose) e das Cianobactérias (evento seguinte e restrito ao ancestral dos eucariotas fotossintéticos).
Numa relação endossimbiótica a transição de um endossimbionte para um organito permanente deve permitir que o hospedeiro ganhe controlo sobre o primeiro e envolve várias fases: a) uma relação predador-presa, do tipo fagotrófica, b) o estabelecimento de mecanismos de controlo de trocas metabólicas entre o hospedeiro e o endossimbionte e, c) a transformação do endossimbionte num organito que perdeu parte dos seus genes, tendo outros deles sido transferidos para o núcleo do hospedeiro (do inglês endosymbiotic gene transfer — EGT). As proteínas codificadas por esses genes continuam a funcionar nos plastídios, sendo marcadas pós-translação com um líder N-terminal, designado por péptidos de trânsito, que são reconhecidos pelos complexos proteicos nas membranas interna (TICs) e externa (TOCs) dos cloroplastos2.
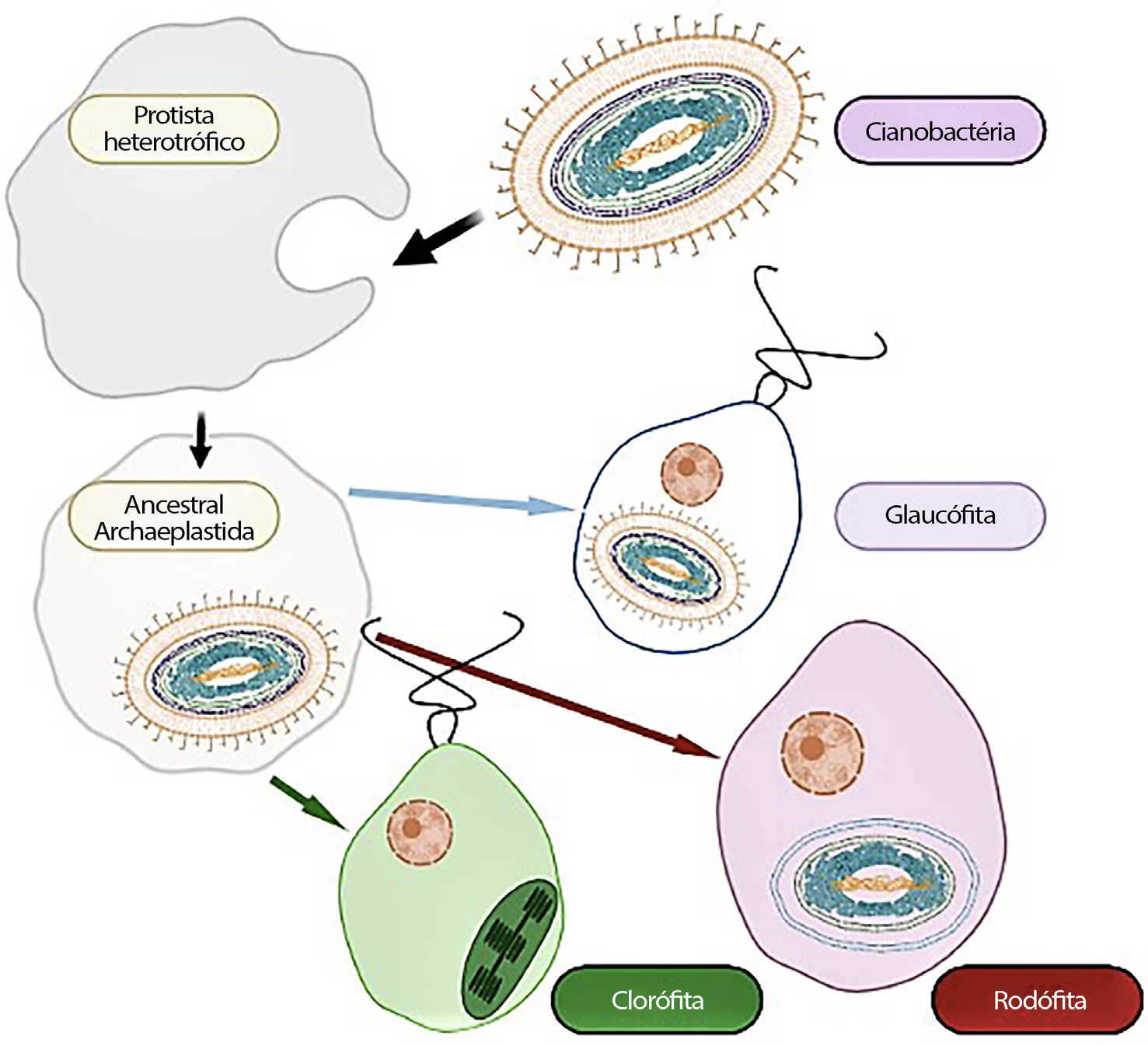
A endossimbiose primária dos plastídios deu origem aos cloroplastos das Glaucophyta, Rhodophyta (algas vermelhas) e Chlorophyta (algas verdes) que, em conjunto, constituem os Archaeplastida (FIGURA 1). Tanto os plastídios das algas vermelhas como os das algas verdes foram adquiridos, de modo independente e posteriormente, por outras linhagens heterotróficas, formando plastídios secundários rodeados por três, quatro ou mesmo cinco membranas.
A origem única ou múltipla dos plastídios primários das três linhagens tem sido bastante debatida, mas atualmente dados moleculares dos genes plastidiais suportam a origem monofilética dos plastídios primários, embora análises preliminares de proteínas citoplasmáticas codificadas pelo núcleo dos plastídios primários permitam duvidar dessa origem única8. Se admitirmos a origem monofilética destes plastídios, teremos de colocar a questão: qual das linhagens surgiu primeiro? As árvores filogenéticas mais prováveis tendem a favorecer o filo Glaucophyta como o mais primitivo, ramificando-se nas Rhodophyta e Chlorophyta.
As Glaucophyta são um pequeno grupo de microalgas dulçaquícolas, com cerca de duas dezenas de espécies de ocorrência rara. Os seus plastídios, designados por cianelas, são únicos sendo frequentemente apresentados como um estádio intermédio entre um endo- -simbionte e um plastídio pois retêm a camada de peptidoglicano entre as duas membranas, apresentando como pigmentos fotossintéticos a clorofila a e as ficobilinas, organizados em ficobilissomas, como na maioria das Cianobactérias. As Rhodophyta constituem um grupo vasto e diverso de micro e macroalgas, presentes em ambientes de água doce e marinhos. Os plastídios deste grupo possuem como pigmentos clorofilas a e d, ficobilinas, também organizados em ficobilissomas. Por último, as Chlorophyta possuem plastídios com as clorofilas a e b, organizadas em tilacóides (FIGURA 1), constituindo um grupo de diversidade elevada encontrado frequentemente em água doce. É pois considerado que os plastídios primários evoluíram a partir de um evento único.
Há no entanto três casos extraordinários, que requerem atenção e que envolvem os cercozoários Paulinella chromatophora, P. micropora e P. longichromatophora, amibas aquáticas que adquiriram dois plastídios, que na realidade são duas cianobactérias simbiontes (similares a Synechococcus) em forma de rim10.
Isolada pela primeira vez pelo biólogo alemão Robert Lauterborn em 1894, P. chromatophora tem uma longa, mas intervalada e pontual história, na literatura científica, tendo sido colocado no centro da discussão da origem endossimbiótica dos plastídios13. P. chromatophora é filogeneticamente próxima de Paulinella ovalis, desprovida de endo- simbiontes, mas que se alimenta preferencialmente de Synechococcus spp., por pseudópodes, característicos destas amibas.
P. chromatophora não necessita de se alimentar, pois os seus hóspedes transferem-lhe produtos fotossintéticos. Curiosamente, os endossimbiontes não podem ser cultivados independentemente e sincronizam a sua divisão com a do hospedeiro.
Apesar dos endossimbiontes manterem o peptidoglicano (uma característica notavelmente similar a outra endossimbiose primária, a ocorrida nas Glaucophyta), o seu genoma foi reduzido significativamente, estimando-se que mais de 30 genes tenham sido transferidos para o núcleo do hospedeiro11. P. chromatophora tornou-se um modelo da endossimbiose usado na investigação científica, sendo largamente aceite como o segundo evento de endossimbiose primária, com uma cianobactéria, evento que terá acontecido há pelo menos 90 milhões de anos5.
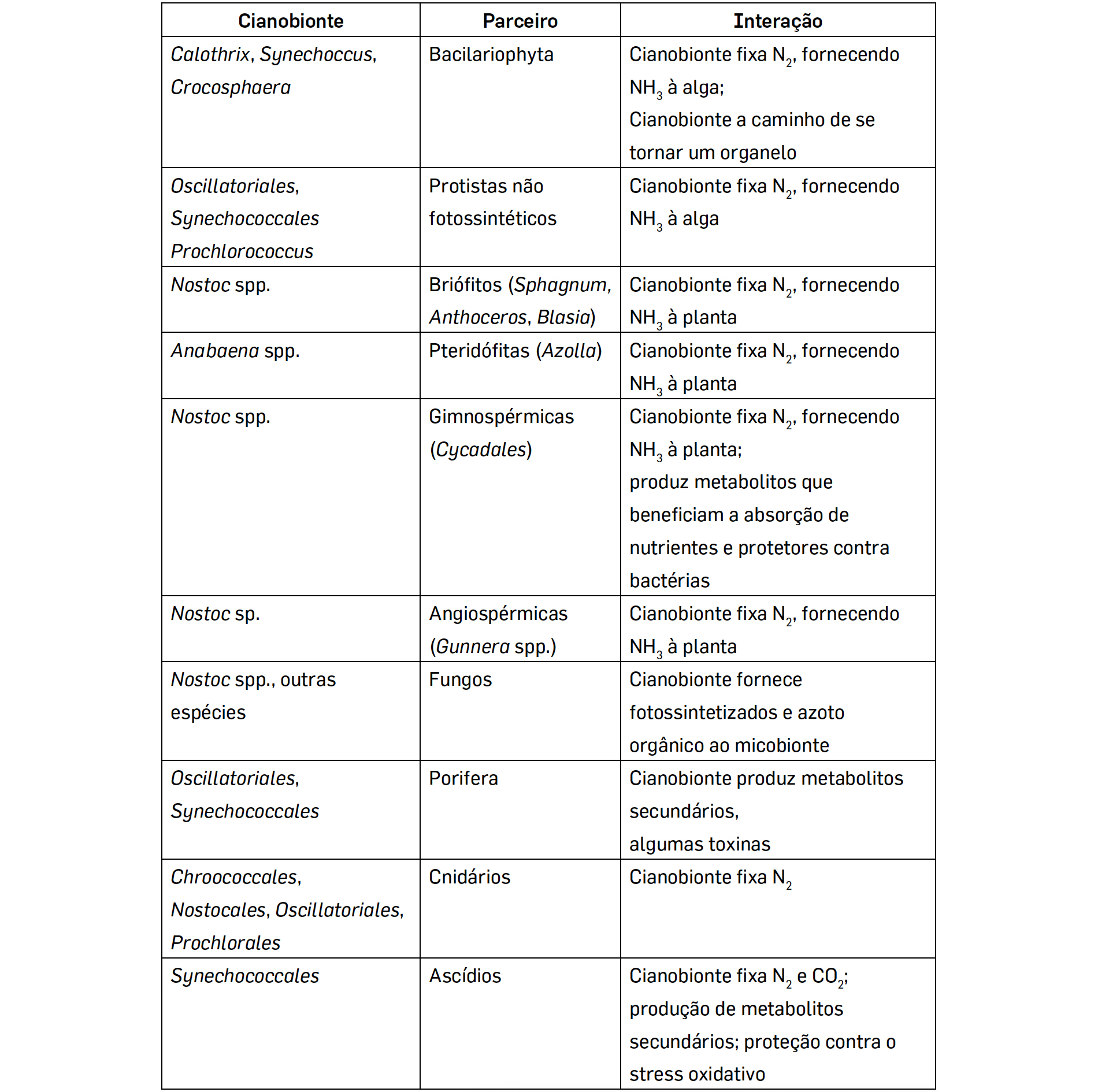
Na maioria destes casos, as cianobactérias envolvidos em mutualismos e simbioses (cianobionte) pertencem aos géneros Nostoc e Anabaena (ordem Nostocales), espécies filamentosas com a capacidade de formar heterocistos, células especializadas na fixação do Azoto atmosférico em NH3. Nas simbioses, ambos os parceiros envolvidos beneficiam da associação: o cianobionte tem um contínuo aporte de nutrientes e é protegido pelo hospedeiro da desidratação e dos herbívoros e, em troca, fornece-lhe fotossintetizados, oxigénio e, no caso das cianobactéroas diazotróficas, formas orgânicas de azoto, permitindo a este colonizar ambientes pobres neste nutriente16.
As Cianobactérias estão envolvidas em simbioses com organismos filogeneticamente distintos como Fungos, Protozoários, Protistas, Plantas e mesmo Animais (TABELA 1).
A associação com Protistas heterotróficos unicelulares pode envolver tanto a fixação de N2 como a fotossíntese. A maioria dos Protistas heterotróficos adquire os cianobiontes por fagocitose e a associação não é obrigatória. Pelo contrário, todas as espécies de Gunnera estabelecem endossimbioses, de carácter obrigatório com as Cianobactérias.
De igual modo, nos Ascídios, animais tunicados, a relação com as cianobactérias é obrigatória, sendo mesmo transmitidos verticalmente à geração seguinte7, colocando inúmeras questões, entre elas como a bactéria suprime ou evita o sistema imunitário do animal.
Todas estas relações pouco convencionais que têm vindo a ser descobertas estão a alterar conceitos como mutualismo/parasitismo, transiente/permanente, predador/presa, heterotrófico/autotrófico, muitos deles baseados na ecologia macroscópica, mas que parecem estar desajustados à realidade da ecologia microbiana.
Conclusões e Reflexões
Devemos abandonar o paradigma de que o nascimento de organelos é excecionalmente raro ao longo da evolução eucariota?
O caso dos cercozoários (e.g. P. chromatophora) poderá ser usado como modelo de uma endossimbiose primária? É surpreendente a evolução convergente com várias centenas de milhões de anos de diferença: uma cianobactéria a estabelecer uma relação estável com um protista, originando um organelo fotossintético rodeado por 2 membranas, EGT e perda de genes, com controlo do fluxo de metabolitos hóspede/hospedeiro.
As Cianobactérias têm uma enorme plasticidade para estabelecer associações, de maior ou menor dependência, com organismos filogeneticamente distantes. Esta característica é única ou está disseminada noutros grupos e estamos apenas no início da descoberta?
Agradecimentos
Financiamento Base da Unidade de Investigação Centro de Investigação e Tecnologias Agroambientais e Biológicas: (CITAB), UIDB/04033/2020, por fundos nacionais através da FCT/MCTES (PIDDAC).
Referências
- 1 ADAMS, D. G. & DUGGAN, P. S., Cyanobacteria-bryophyte symbioses, Journal of Experimental Botany, 59, 5, 1047– 1058. 2008.
- 2 BODYŁ, A. & MACKIEWICZ, P., Endosymbiotic theory, Brenner’s Encyclopedia of Genetics, 2nd edition, Volume 2, p 484–492. 2013.
- 3 BOGORAD, L., Discovery of chloroplast DNA genomes and genes, World Scientific, Singapore, Volume 2, p 15–44. 1998.
- 4 CHANG, A. C. G. et al., Perspectives on endosymbiosis in coralloid roots: association of cycads and cyanobacteria, Frontiers in Microbiology, 10, 1888. 2019.
- 5 DELAYE, L. et al., How really ancient is Paulinella chromatophora?, PLOS Currents Tree of Life, 1. 2016.
- 6 ERNSTER, L. & SCHATZ, G., Mitochondria: a historical review, The Journal of Cell Biology, 91, 3, 227–255. 1981.
- 7 HIROSE, E., Ascidian photosymbiosis: diversity of cyanobacterial transmission during embryogenesis, Genesis, 53, 1, 121–131. 2015.
- 8 KEELING, P. J., Diversity and evolutionary history of plastids and their hosts, American Journal of Botany, 91, 1481– 1493. 2004.
- 9 KOCIOLEK, P. J. & HAMSHER, S., Algal and Cyanobacteria Symbioses, World Scientific, pp. 371–397. 2017.
- 10 LHEE, D. et al., Evolutionary dynamics of the chromatophore genome in three photosynthetic Paulinella species, Scientific Reports, 9: 2560. 2019.
- 11 MACKIEWICZ, P. et al., Possible import routes of proteins into the cyanobacterial endosymbionts/plastids of Paulinella chromatophora, Theory in Biosciences, 131, 1–18. 2012.
- 12 MARGULIS, L., Evolutionary criteria in Thallophytes: A radical alternative, Science, 161, 1020–1022. 1968.
- 13 MELKONIAN, M. & MOLLENHAUER, D., Robert Lauterborn (1869-1952) and his Paulinella chromatophora, Protist, 156, 2, 253–262. 2005.
- 14 MUTALIPASSI, M. et al., Symbioses of Cyanobacteria in Marine Environments: Ecological Insights and Biotechnological Perspectives, Marine Drugs, 19, 4, 227. 2021.
- 15 PEREIRA, A. L., The unique symbiotic system between a fern and a cyanobacterium, Azolla-Anabaena azollae: their potential as biofertilizer, feed, and remediation, Symbiosis. 2017. DOI: 10.5772/intechopen.70466.
- 16 RASMUSSEN, U. & JOHANSSON, C., Diversity and specificity in cyanobacterial symbioses, Proceedings of the Royal Irish Academy, 102, 53–56. 2002.
- 17 RIKKINEN, J., Algal and Cyanobacteria Symbioses, World Scientific, pp. 147–167. 2017.
- 18 RIKKINEN, J., Modern Topics in the Phototrophic Prokaryotes - Environmental and Applied Aspects, Springer, Cham, pp. 243-294. 2017.
Este artigo já foi visualizado 5032 vezes.



