Solvente eutéctico profundo
📧
- CIQUP/ Universidade do Porto
Referência Santos, L.M.N.B.F., (2017) Solvente eutéctico profundo, Rev. Ciência Elem., V5(2):021
DOI http://doi.org/10.24927/rce2017.021
Palavras-chave Solvente; Eutéctico; DES; Sólido; Líquido; Fase; Ião; Sal; Ureia;
Resumo
Os chamados solventes eutécticos profundos, DES – ‘Deep Eutectic Solvents’ –, são soluções líquidas (com uma baixa temperatura de fusão) em que a diminuição da temperatura de fusão na composição eutéctica resulta de um forte desvio à idealidade da mistura líquida, como consequência da interação ácido-base entre os seus constituintes que leva a uma estabilização significativa da fase líquida relativamente aos líquidos puros e às suas fases sólidas.
Estes sistemas são formados a partir de misturas de ácidos e bases de Lewis ou Brønsted que podem conduzir à formação de uma variedade de espécies aniónicas e/ou catiónicas1, que são classificados como solventes iónicos com propriedades especiais. Incorporam dois ou mais compostos numa mistura que formam um eutéctico com um ponto de fusão muito menor do que qualquer um dos componentes individuais2. O eutéctico profundo conhecido é o que se observa na mistura de cloreto de colina e ureia na razão molar de 1 para 2 (figura 1). A mistura resultante tem um ponto de fusão de 12 °C (muito inferior ao ponto de fusão da colina, 302 °C e da ureia, 133 °C)3, que o torna líquido à temperatura ambiente.
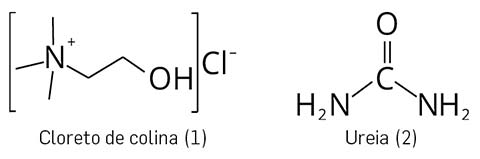
Os solventes eutécticos profundos de primeira geração basearam-se em misturas de sais de amónio quaternário com dadores de ligação de hidrogénio tais como aminas e ácidos carboxílicos. Existem quatro tipos4:
- Tipo I sal de amónio quaternário + cloreto metálico
- Tipo II sal de amónio quaternário + cloreto de metal hidratado
- Tipo III sal de amónio quaternário + dador de ligação de hidrogénio
- Tipo IV cloreto de metal hidratado + dador de ligação de hidrogénio
Na figura 2, são apresentados os diagramas de fase de misturas de dois componentes, A e B. O eixo horizontal representa a composição da mistura e o eixo vertical a temperatura de equilíbrio para as diferentes composições no diagrama. Quando a diminuição da temperatura eutéctica é muito acentuada, como está representada no diagrama, encontramo-nos perante um sistema de eutéctico profundo.
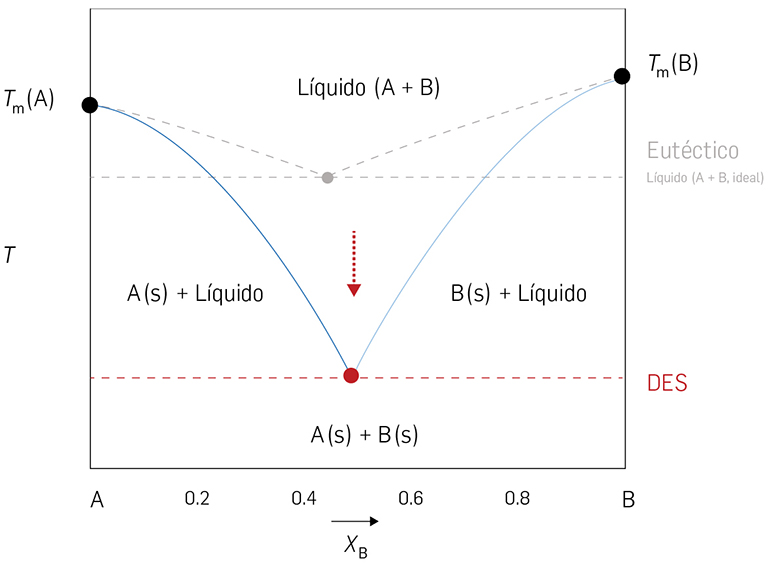
Tomando como exemplo a mistura de cloreto de colina e ureia3, quando misturados na proporção eutéctica (proporção molar de 1 de cloreto de colina para 2 de ureia), a mistura apresenta uma temperatura eutéctica várias dezenas de graus abaixo do previsto no diagrama com eutéctico resultante da mistura líquida ideal (tal como esquematizado na figura 2). A ureia (aceitador em pontes de hidrogénio) interatua na fase líquida com o cloreto de colina (sal de tetraalquilamónio, dador em ligações de hidrogénio), conduzindo a uma significativa estabilização da solução, levando a uma grande diminuição da temperatura de fusão da mistura em relação às dos componentes sólidos e à temperatura da mistura eutéctica do eutéctico hipotético resultante da mistura líquida ideal.
Referências
- 1 Smith EL, Abbott, AP, Ryder, KS (2014), Deep Eutectic Solvents (DESs) and Their Applications, Chem. Rev. 114: 11060–11082. doi:10.1021/cr300162p.
- 2 Deep Eutectic Solvents, (PDF). kuleuven.be. University of Leicester. Retrieved 17 June 2014.
- 3 Abbott, AP, Capper, G, Davies DL, Rasheed, RK, Tambyrajah, V, (2003), Novel solvent properties of choline chloride/urea mixtures, Chem. Commun: 70–71. doi:10.1039/B210714G.
- 4 Abbott, AP, Barron, J, Ryder, K, Wilson, D, (2007), Eutectic-Based Ionic Liquids with Metal-Containing Anions and Cations, Chem. Eur. J. 13: 6495–6501. doi:10.1002/chem.200601738.
Este artigo já foi visualizado 5950 vezes.



