Gilbert Lewis
📧
- DQB/ Universidade de Lisboa
Referência Maia, R. G., (2020) Gilbert Lewis, Rev. Ciência Elem., V8(1):002
DOI http://doi.org/10.24927/rce2020.002
Palavras-chave Termodinâmica, Notação de Lewis, Estrutura de Lewis, The Atom and the Molecule, Ligação de valência, Ácido e base
Resumo
Gilbert Newton Lewis (1875–1946), químico e físico norte-americano, distinguiu-se em três áreas científicas: termodinâmica, ligação química e isótopos. O seu livro Thermodynamics and the Free Energy of Chemical Substances foi uma obra fundamental no ensino universitário. As configurações eletrónicas de valência de acordo com a famosa notação de Lewis ilustram a ligação química e permitiram novos conceitos de ácido e de base. Os seus estudos sobre a água pesada foram relevantes no desenvolvimento da química isotópica. Lewis foi um inovador na dinâmica ensino/investigação na universidade.
Gilbert Lewis foi o segundo filho do casal Frank Wesley Lewis e Mary Burr White. Nasceu em Weymouth, Massachusetts, EUA, em outubro de 1875. Tinha uma irmã, Mary Hannibal, e veio a ter um irmão, Roger. A mãe recebera uma esmerada educação e o pai era advogado e corretor. Durante a infância e parte da adolescência, Gilbert Lewis (FIGURA 1) auferiu ensino informal, em casa. Muito precoce, lia aos três anos de idade. Aprendeu latim, grego, alemão e francês, escrevia com elegância e humor, sabia química, física e matemática, e dominava temas de antropologia, geologia, biologia e economia. Música, literatura, história e teatro faziam parte da sua cultura geral. Em contrapartida, a fraca sociabilização a que foi votado não lhe terá sido benéfica.

A Universidade de Nebrasca acolheu-o aos catorze anos para estudos preparatórios, seguindo-se o Harvard College, onde veio a graduar-se em química em 1896. É na Universidade de Harvard que obtém, em 1899, o Ph.D. sob a orientação de T. W. Richards (1868-1928). Um ano depois, Lewis rumou à Europa com uma bolsa de estudo. Passa um semestre em Leipzig, junto de Wilhelm Ostwald (1853-1932), e outro em Göttingen, junto de Walther Nernst (1864-1941). Em 1902 regressa à Universidade de Harvard, como instrutor no Departamento de Química.
Inesperadamente, parte à aventura. Durante cerca de dois anos será superintendente no Instituto de Pesos e Medidas nas ilhas Filipinas e químico na Secretaria de Ciências de Manila. Em 1905, de volta aos EUA, integra o grupo de químico-físicos do MIT – Massachusetts Institute of Technology, liderado por Arthur Noyes (1866-1936).
Lewis valorizava o trabalho rigoroso de Willard Gibbs (1839-1903) e de Pierre Duhem (1861-1916) em termodinâmica. Decidiu empreender uma reformulação do tratamento termodinâmico, aplicando-o à química de forma acessível e útil – da força eletromotriz à “energia livre”, passando por dois conceitos que considerou fundamentais: a “atividade” e a “fugacidade”. Durante os sete anos de permanência no MIT, Lewis publicou muitos artigos sobre o tema. Torna-se full professor. Em 1923 publica Thermodynamics and the Free Energy of Chemical Substances, em colaboração com Merle Randall (1888-1950), obra que veio a influenciar profundamente o estudo da química.
A Universidade da Califórnia, Berkeley, oferece-lhe a direção do College of Chemistry. Gilbert Lewis aceita e aplica a sua organização de ensino/investigação: a investigação é introduzida nos primeiros estádios do ensino universitário, sob a orientação de professores; os alunos graduados são encorajados a desenvolver projetos próprios; numa reunião semanal expõe-se e discute-se trabalho. Foram muitos os que floresceram sob a orientação de Lewis. E muitas as escolas que o copiaram com excelentes resultados.
Desde 1902 que Gilbert Lewis explorava o nível atómico-molecular. Idealizara os átomos como estruturas cúbicas com eletrões nos vértices. A ligação química produzir-se-ia por “partilha”, não por “transferência”, de eletrões externos, de acordo com a regra do octeto. Em 1916, publica o famoso artigo The Atom and the Molecule. Em 1923, surge o livro fundamental Valence and the Structure of Atoms and Molecules. A notação de Lewis ou estrutura de Lewis (FIGURA 2), tão familiar aos alunos do ensino secundário, já celebrou um século de existência.
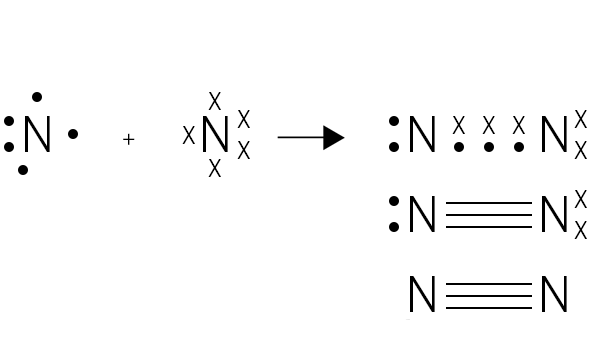
Pares de eletrões de valência são representados por um traço, cada eletrão de ligação por um simples ponto ou cruz. Em paralelo, Gilbert Lewis, introduziu um novo conceito de ácido e base. Uma espécie que receba pares de eletrões é um ácido e uma que os ceda é uma base. Esta extensão da teoria da ligação de valência e dos seus pares de eletrões surge em 1938.
Logo após a descoberta do deutério por Harold Urey (1893-1981) em 1931, Lewis e colegas estudaram propriedades físicas do deutério e da água pesada e o seu efeito na ionização de ácidos e de bases no crescimento e desenvolvimento de plantas e animais.
Gilbert Lewis foi o cientista mais vezes nomeado para receber o Prémio Nobel da Química (35 vezes), o que nunca lhe foi concedido – uma injustiça monumental. A forma restrita de olhar, ao tempo, o legado de Nobel, a frontalidade agressiva de Lewis em relação a reputados cientistas, a sua animosidade para com Irving Langmuir (1881-1957) e o seu isolamento social foram fatores determinantes. Gilbert Lewis sentiu-se magoado. Foram muitas as honras que recebeu e muitas as que declinou. Merecem especial relevo a atribuição do Willard Gibbs Award (1924) e da Davy Medal (1928); e a criação post mortem da Gilbert Newton Lewis Medal pela American Chemical Society (secção da Califórnia).
Em 1912 Gilbert Newton Lewis desposou Mary Hinckley Sheldon, filha de Edward Stevens Sheldon, distinto professor da Universidade de Harvard. O casal teve três filhos: Richard Newton em 1916, Margery em 1917 e Edward Sheldon em 1920. Os dois rapazes foram químicos. Lewis veio a falecer no seu laboratório, em março de 1946, no decurso de uma experiência envolvendo cianeto de hidrogénio. Um pacto de silêncio envolve a sua morte.
Um charuto, um jogo de póquer e um raro poder de raciocínio e de planeamento, assim era Gilbert Newton Lewis, um dos mais fecundos químicos do século XX.
Referências
- 1 COFFEY, P. Cathedrals of Science - The Personalities and Rivalries That Made Modern Chemistry, Oxford University Press, Oxford. 2008.
- 2 GONÇALVES-MAIA, R. Gilbert Lewis – O Átomo e a Molécula, Coleção Dos Átomos e das Moléculas, vol. 1, Edições Colibri, Lisboa, 2017; LF Editorial, nº 1, São Paulo. 2016.
- 3 LACHMAN, A. Borderland of the Unknown – The Life Story of Gilbert Newton Lewis, One of the World’s Great Scientists, Pageant Press, Nova Iorque, 1955.
Este artigo já foi visualizado 8114 vezes.



